–Ю–њ—Л—В –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ –≤ –Ї–ї–Є–љ–Є–Ї–µ "–•–∞–і–∞—Б—Б–∞"
–Ъ–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ —Г–ї—Г—З—И–∞–µ—В —А–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Є—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —О–≤–µ–љ–Є–ї—М–љ—Л–Љ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ (–Я—Г–±–ї–Є–Ї–∞—Ж–Є—П –≤ –ґ—Г—А–љ–∞–ї–µ Pediatric Blood Cancer (Pediatr Blood Cancer. 2015 Oct 20. doi: 10.1002/pbc.25801))
–Т–Т–Х–Ф–Х–Э–Ш–Х
–Р—Г—В–Њ—Б–Њ–Љ–љ–Њ-—А–µ—Ж–µ—Б—Б–Є–≤–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј, —В–∞–Ї–ґ–µ –Є–Ј–≤–µ—Б—В–љ—Л–є –Ї–∞–Ї —О–≤–µ–љ–Є–ї—М–љ—Л–є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј (–Ѓ–Ч–Ю), - —П—Б–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –і–ї—П –Ї–Њ—В–Њ—А–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–љ—Л –≤—Л—Б–Њ–Ї–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М. –Ф–∞–љ–љ–Њ–µ —А–µ–і–Ї–Њ–µ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б —З–∞—Б—В–Њ—В–Њ–є 1:200,000 - 1:300,000, –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ –Ъ–Њ—Б—В–∞-–†–Є–Ї–µ, —А–µ—Б–њ—Г–±–ї–Є–Ї–µ –І—Г–≤–∞—И–Є—П –≤ –†–Њ—Б—Б–Є–Є –Є –љ–∞ –°—А–µ–і–љ–µ–Љ –Т–Њ—Б—В–Њ–Ї–µ .[1вАУ5] –Ѓ–Ч–Ю —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Њ—Б–ї–∞–±–ї–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–µ–є –∞–љ–Њ–Љ–∞–ї—М–љ—Г—О —А–µ–Ј–Њ—А–±—Ж–Є—О –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л. –°–љ–Є–ґ–µ–љ–Є–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є –њ—А–Є–≤–Њ–і–Є—В –Ї –Є—Е –Њ—Б–ї–∞–±–ї–µ–љ–Є—О, –Ї–Њ—Б—В–Є —Б—В–∞–љ–Њ–≤—П—В—Б—П —Е—А—Г–њ–Ї–Є–Љ–Є –Є –њ–Њ–і–≤–µ—А–ґ–µ–љ–љ—Л–Љ–Є –њ–µ—А–µ–ї–Њ–Љ–∞–Љ.[6]
–Ѓ–Ч–Ю –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Г –і–µ—В–µ–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ –њ–µ—А–≤—Л–є –≥–Њ–і –ґ–Є–Ј–љ–Є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ—А–Є–±–∞–≤–Ї–Є –≤ –≤–µ—Б–µ, –Љ–∞–Ї—А–Њ—Ж–µ—Д–∞–ї–Є–µ–є –Є –≤—Л—Б—В—Г–њ–∞—О—Й–Є–Љ–Є –ї–Њ–±–љ—Л–Љ–Є –±—Г–≥—А–∞–Љ–Є. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П —З–µ—А–µ–њ–∞ –Љ–Њ–≥—Г—В –њ—А–Є–≤–µ—Б—В–Є –Ї –≥–Є–і—А–Њ—Ж–µ—Д–∞–ї–Є–Є –Є —Е–Њ–∞–љ–∞–ї—М–љ–Њ–Љ—Г —Б—В–µ–љ–Њ–Ј—Г. –Ъ –і—А—Г–≥–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—В–љ–Њ—Б—П—В—Б—П –Љ–Є–Ї—А–Њ–≥–љ–∞—В–Є—П (–љ–µ–і–Њ—А–∞–Ј–≤–Є—В–Є–µ —З–µ–ї—О—Б—В–µ–є), —Г–Ј–Ї–∞—П –≥—А—Г–і–љ–∞—П –Ї–ї–µ—В–Ї–∞, –њ–µ—А–µ–ї–Њ–Љ—Л, –≥–µ–њ–∞—В–Њ—Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є—П (–Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ–ї–µ–Ј–µ–љ–Ї–Є –Є –њ–µ—З–µ–љ–Є), –≥–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П, –і–µ—Д–µ–Ї—В—Л –њ—А–Є –њ—А–Њ—А–µ–Ј—Л–≤–∞–љ–Є–Є –Ј—Г–±–Њ–≤ –Є —Б–Є–ї—М–љ—Л–є –Ј—Г–±–љ–Њ–є –Ї–∞—А–Є–µ—Б.
–Я–∞—В–Њ–ї–Њ–≥–Є—П –Ї–Њ—Б—В–µ–є –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О —З–µ—А–µ–њ–љ—Л—Е –љ–µ—А–≤–Њ–≤, –њ—А–Є–≤–Њ–і—П—Й—Г—О –Ї —Б–ї–µ–њ–Њ—В–µ –Є –≥–ї—Г—Е–Њ—В–µ –Є–ї–Є, —А–µ–ґ–µ, –Ї –њ–∞—А–µ–Ј—Г –ї–Є—Ж–µ–≤–Њ–≥–Њ –љ–µ—А–≤–∞ –Є–ї–Є –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П–Љ –≤ –Ї–Њ—А–Љ–ї–µ–љ–Є–Є –Є –≥–ї–Њ—В–∞–љ–Є–Є. [1,2,7] –£ –і–µ—В–µ–є, —Б—В—А–∞–і–∞—О—Й–Є—Е –Ѓ–Ч–Ю, —З–∞—Б—В–Њ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Ї–Њ—В–Њ—А–∞—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є, –∞–љ–µ–Љ–Є–µ–є –Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є –њ–Њ –њ—А–Є—З–Є–љ–µ –љ–µ–є—В—А–Њ–њ–µ–љ–Є–Є, –Є –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –ї–µ—В–∞–ї—М–љ–Њ–Љ—Г –Є—Б—Е–Њ–і—Г –≤ –њ–µ—А–≤–Њ–Љ –і–µ—Б—П—В–Є–ї–µ—В–Є–Є –ґ–Є–Ј–љ–Є. [3,8]
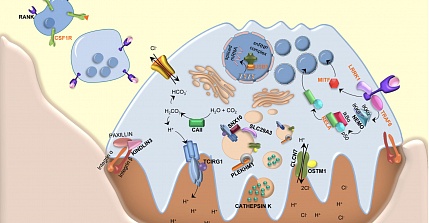
–Т –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–Њ–≤–ї–µ—З–µ–љ—Л –Љ—Г—В–∞—Ж–Є–Є –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –≥–µ–љ–∞—Е, –≤–ї–Є—П—О—Й–Є–µ –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—О (–љ–∞–њ—А–Є–Љ–µ—А, RANK –Є RANKL) –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ (TCIRG1, CLCN7, OSTM1, CA-II –Є PLEKHM1) –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤. –Я–∞—В–Њ–≥–µ–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –і–∞–љ–љ—Л—Е –≥–µ–љ–∞—Е –њ—А–Њ—П–≤–ї–µ–љ—Л –≤ 70 % —Б–ї—Г—З–∞—П—Е –Ѓ–Ч–Ю.[1вАУ 3,9вАУ12] –Ь—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ TCIRG1 –≤—Б—В—А–µ—З–∞—О—В—Б—П –њ—А–Є–Љ–µ—А–љ–Њ –≤ 50% —Б–ї—Г—З–∞–µ–≤. –Э–µ–і–∞–≤–љ–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ–∞—П –њ–∞—В–Њ–≥–µ–љ–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –≥–µ–љ–∞ SNX1, –Њ–њ–Є—Б–∞–љ–љ–∞—П –і-—А–Њ–Љ –Р–Ї–µ—А–Њ–Љ —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є, –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –∞–љ–Њ–Љ–∞–ї—М–љ–Њ –Љ–µ–ї–Ї–Є—Е –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ї —А–µ–Ј–Њ—А–±—Ж–Є–Є. –Я–Њ–Є—Б–Ї –і—А—Г–≥–Є—Е –±–Њ–ї–µ–Ј–љ–µ—В–≤–Њ—А–љ—Л—Е –≥–µ–љ–Њ–≤ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П.
–Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ —А–∞–і–Є–Ї–∞–ї—М–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –Ѓ–Ч–Ю —П–≤–ї—П–µ—В—Б—П –∞–ї–ї–Њ–≥–µ–љ–љ–∞—П –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–∞—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї (–Ґ–У–°–Ъ).[1,2,15] –£—Б–њ–µ—И–љ–∞—П –Ґ–У–°–Ъ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—О –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –Є, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ, –Ї —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О –Ї–Њ—Б—В–µ–є –Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–∞ –≥–µ–Љ–∞—В–Њ–њ–Њ—Н–Ј–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –Ґ–У–°–Ъ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ —Г –і–µ—В–µ–є —Б –Ѓ–Ч–Ю. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П –≤–Ї–ї—О—З–∞—О—В —В—А—Г–і–љ–Њ—Б—В–Є –≤ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–≥–Њ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї, –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Г—О —Б–Љ–µ—А—В—М –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –≤ —Б–≤—П–Ј–Є —Б –ї–µ–≥–Њ—З–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є, –≤–µ–љ–Њ–Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ—Г—О –±–Њ–ї–µ–Ј–љ—М –њ–µ—З–µ–љ–Є (–Т–Ю–С) –Є —Б–µ–њ—Б–Є—Б.[15вАУ18]
–†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ґ–У–°–Ъ –њ—А–Є –Ѓ–Ч–Ю –і–Њ—Б—В—Г–њ–љ—Л, –љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ—Л, –Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –љ–∞–Є–ї—Г—З—И–µ–≥–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т —Б–µ—А–µ–і–Є–љ–µ 90-—Е –≥–Њ–і–Њ–≤ –њ—А–Њ—И–ї–Њ–≥–Њ —Б—В–Њ–ї–µ—В–Є—П –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ґ–У–°–Ъ –њ—А–Є –Ѓ–Ч–Ю –±—Л–ї –≤–≤–µ–і–µ–љ —А–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Ф–∞–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–Є–ї —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П. –Т —Б—В–∞—В—М–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—И–µ–≥–Њ –Њ–њ—Л—В–∞ –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –і–µ—В–µ–є —Б –Ѓ–Ч–Ю —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—О—Й–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ.
________________________________________________
–Р–±–±—А–µ–≤–Є–∞—В—Г—А—Л: –Р–Ґ–У - –∞–љ—В–Є—В–Є–Љ–Њ—Ж–Є—В–∞—А–љ—Л–є –≥–ї–Њ–±—Г–ї–Є–љ; –Ъ–Ь вАУ –Ї–Њ—Б—В–љ—Л–є –Љ–Њ–Ј–≥; –¶—Б–Р вАУ —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ –Р; –Т–Я–С–Ч вАУ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П; ESID вАУ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–µ –Њ–±—Й–µ—Б—В–≤–Њ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞; –†–Ґ–Я–• вАУ —А–µ–∞–Ї—Ж–Є—П ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї; –Ґ–У–°–Ъ вАУ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Є—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї; IEWPвАУEBMT –†–∞–±–Њ—З–∞—П –≥—А—Г–њ–њ–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ї—А–Њ–≤–Є –Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞; –Ѓ–Ч–Ю вАУ —О–≤–µ–љ–Є–ї—М–љ—Л–є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј; –°–†–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –°–Э–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –Ю–Т вАУ –Њ–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М; –°–Ъ–Я–Ъ вАУ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є; –Т–Ю–С вАУ –≤–µ–љ–Њ–Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М.
[nextpage title="–Ґ–Р–С–Ы–Ш–¶–Р 1. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –і–Њ–љ–Њ—А–Њ–≤"]
–Ґ–Р–С–Ы–Ш–¶–Р 1. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –і–Њ–љ–Њ—А–Њ–≤
at вАУ –Ј–љ–∞—З–µ–љ–Є–µ –Ї—А–Є—В–µ—А–Є—П. b —В–Њ—З–љ—Л–є –Ї—А–Є—В–µ—А–Є–є –§–Є—И–µ—А–∞; –°–Ф–° вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –і–Њ–љ–Њ—А-—Б–Є–±–ї–Є–љ–≥; –°–†–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –Э–°–†–Ф вАУ –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –°–Э–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –Э–°–Э–Ф вАУ –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –¶–Ь–Т вАУ —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б; –°–Ъ–Я–Ъ вАУ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є.
[nextpage title="–Я–Р–¶–Ш–Х–Э–Ґ–Ђ –Ш –Ь–Х–Ґ–Ю–Ф–Ђ"]
–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤
–Т –і–∞–љ–љ–Њ–µ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 38 –і–µ—В–µ–є —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –Ѓ–Ч–Ю (29 –Љ–∞–ї—М—З–Є–Ї–Њ–≤ –Є 9 –і–µ–≤–Њ—З–µ–Ї), –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є 39 –њ—А–Њ—Ж–µ–і—Г—А –У–Ґ–°–Ъ –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ —Ж–µ–љ—В—А–µ ¬Ђ–•–∞–і–∞—Б—Б–∞¬ї –њ—А–Є –Х–≤—А–µ–є—Б–Ї–Њ–Љ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–µ –≤ –њ–µ—А–Є–Њ–і —Б –і–µ–Ї–∞–±—А—П 1983 –≥. –њ–Њ –Њ–Ї—В—П–±—А—М 2014 –≥. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –і–Є–∞–≥–љ–Њ–Ј –Ѓ–Ч–Ю –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –±–Є–Њ–њ—Б–Є–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –∞ —В–∞–Ї–ґ–µ, —Б 2008 –≥, –і–∞–љ–љ—Л–Љ–Є –Љ—Г—В–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ –Ґ–У–°–Ъ –≤—Б–µ –Њ–њ–µ–Ї—Г–љ—Л –њ–Њ–і–њ–Є—Б—Л–≤–∞–ї–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–і–Њ–±—А–µ–љ–Њ –≠–Ї—Б–њ–µ—А—В–љ—Л–Љ —Б–Њ–≤–µ—В–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є ¬Ђ–•–∞–і–∞—Б—Б—Б–∞¬ї. –Ф–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ I.
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї –њ–Њ—Б—В–∞–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 2 –ї–µ—В –ґ–Є–Ј–љ–Є. –Т–Њ–Ј—А–∞—Б—В —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –љ–∞ –Љ–Њ–Љ–µ–љ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–ї –Њ—В 0.07 (1 –Љ–µ—Б—П—Ж) –і–Њ 6.71 –ї–µ—В (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –Њ–Ї–Њ–ї–Њ 8 –Љ–µ—Б—П—Ж–µ–≤). –Т—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М –Ї–∞–Ї –њ–µ—А–Є–Њ–і –≤—А–µ–Љ–µ–љ–Є –Њ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –і–Њ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–≥–Њ –≤–Є–Ј–Є—В–∞. –°—А–µ–і–љ–µ–µ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ–Њ–є —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ 684 –і–љ—П (–Њ—В 123 –і–Њ 10 683 –і–љ–µ–є).
–Ф–∞–љ–љ—Л–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –±—Л–ї–Є –і–Њ—Б—В—Г–њ–љ—Л —Г 28 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (7 –Є–Ј 12 –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –Є 21 –Є–Ј 26 –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ). –£ 18 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Љ—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ TCIRG1 (–Є–Ј –љ–Є—Е –њ—П—В–µ—А–Њ —П–≤–ї—П—О—В—Б—П –љ–Њ—Б–Є—В–µ–ї—П–Љ–Є —Г–љ–Є–Ї–∞–ї—М–љ–Њ–є –І—Г–≤–∞—И—Б–Ї–Њ–є –Љ—Г—В–∞—Ж–Є–Є —Б–∞–є—В–∞ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞, c.807 + 5G>A, —В—А–Њ–µ вАУ –љ–Њ—Б–Є—В–µ–ї—П–Љ–Є —Б–ї–Њ–ґ–љ–Њ–є –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–є –Љ—Г—В–∞—Ж–Є–Є –Є –і–µ—Б—П—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е —Б–µ–Љ–µ–є - –љ–Њ—Б–Є—В–µ–ї—П–Љ–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є –≥–µ–љ–∞ TCIRG1). –°–µ–Љ–µ—А–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Є –Є–Ј –Њ–і–љ–Њ–≥–Њ —А–µ–≥–Є–Њ–љ–∞ –Я–∞–ї–µ—Б—В–Є–љ—Л –Є –Є–Љ–µ–ї–Є –Њ–і–љ—Г –Є —В—Г –ґ–µ –Љ–Є—Б—Б–µ–љ—Б- –Љ—Г—В–∞—Ж–Є—О, c.152 GвЖТA –≤ —Н–Ї–Ј–Њ–љ–µ 3 –≥–µ–љ–∞ SNX10. –Ф–≤–Њ–µ –і–µ—В–µ–є –±—Л–ї–Є –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ—Л –њ–Њ –Љ—Г—В–∞—Ж–Є–Є RANK –Є, —Г –Њ–і–љ–Њ–є –і–µ–≤–Њ—З–Ї–Є –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –≥–µ–љ–∞ CLCN7. –Т—Б–µ –і–µ—В–Є —А–Њ–і–Є–ї–Є—Б—М –Њ—В —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –±—А–∞–Ї–Њ–≤.
–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –і–Њ–љ–Њ—А–Њ–≤
–Ь—Л –њ—А–Є–≤–Њ–і–Є–Љ –Њ–њ–Є—Б–∞–љ–Є–µ –і–≤—Г—Е –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л—Е –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П. –Я–∞—Ж–Є–µ–љ—В—Л –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ (–≥—А—Г–њ–њ–∞ 1, n = 12) –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –і–Њ 1996 –≥–Њ–і–∞ —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –±–µ–Ј —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Я–∞—Ж–Є–µ–љ—В—Л –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ (–≥—А—Г–њ–њ–∞ 2, n = 26), –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —Б–Є–±–ї–Є–љ–≥–Њ–≤ (–±—А–∞—В–∞ –Є–ї–Є —Б–µ—Б—В—А—Л) –Є–ї–Є —З–ї–µ–љ–Њ–≤ —Б–µ–Љ—М–Є. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –і–Њ–љ–Њ—А–Њ–≤ –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ I.
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–Њ–љ–Њ—А–Њ–≤ –≤ –≥—А—Г–њ–њ–µ 1 (n = 12) —П–≤–ї—П–ї–Є—Б—М –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–Љ–Є —З–ї–µ–љ–∞–Љ–Є —Б–µ–Љ—М–Є (10 –Є–Ј 12 - –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–µ —Б–Є–±–ї–Є–љ–≥–Є, 1 - –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і–Є—В–µ–ї—М –Є –µ—Й–µ 1 вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–∞ 9/10 —А–Њ–і–Є—В–µ–ї—П). –Т –≥—А—Г–њ–њ–µ 2 (n = 26), —Г 18 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –і–Њ–љ–Њ—А–Њ–≤ (–°–†–Ф) (14 –Є–Ј 18 –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —Б–Є–±–ї–Є–љ–≥–Њ–≤ –Є 4 –Є–Ј 18 –Њ—В –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ —А–Њ–і–Є—В–µ–ї—П). –£ —В—А–Њ–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞ (–°–Э–Ф), —Г –і–≤–Њ–Є—Е вАУ –Њ—В –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞ (–Њ–і–Є–љ –ї–Њ–Ї—Г—Б–љ—Л–є –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –і–Њ–љ–Њ—А) –Є, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, —В—А–Њ–µ –і–µ—В–µ–є –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –і–Њ–љ–Њ—А–Њ–≤ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ CD34+ T-–Ї–ї–µ—В–Њ—З–љ–Њ–є –і–µ–њ–ї–µ—Ж–Є–Є. –Ш–Ј —Н—В–Є—Е —В—А–Њ–Є—Е –Њ–і–Є–љ —А–µ–±–µ–љ–Њ–Ї –њ—А–Њ—Е–Њ–і–Є–ї –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В –Љ–∞—В–µ—А–Є, —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Ї–Њ—В–Њ—А–Њ–є —П–≤–Є–ї–Њ—Б—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –∞ –Ј–∞—В–µ–Љ –±—Л–ї–∞ —Г—Б–њ–µ—И–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–∞ –њ–Њ–≤—В–Њ—А–љ–∞—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –Њ—В —В–Њ–≥–Њ –ґ–µ –і–Њ–љ–Њ—А–∞ [19]; –і—А—Г–≥–Њ–є —А–µ–±–µ–љ–Њ–Ї, –і–µ–≤–Њ—З–Ї–∞ 6 –ї–µ—В, –њ–µ—А–µ–љ–µ—Б–ї–∞ –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —Б–≤–Њ–µ–є –Љ–∞—В–µ—А–Є, –Ї –љ–µ—Б—З–∞—Б—В—М—О, —Б –ї–µ—В–∞–ї—М–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ –њ–Њ –њ—А–Є—З–Є–љ–µ –Њ—В—В–Њ—А–ґ–µ–љ–Є—П –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞; –∞ —В—А–µ—В–Є–є –њ–∞—Ж–Є–µ–љ—В —Г—Б–њ–µ—И–љ–Њ –њ–µ—А–µ–љ–µ—Б —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —А–Њ–і–љ–Њ–є —В–µ—В–Є.
–Ф–Њ–љ–Њ—А–∞–Љ —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є (–°–Ъ–Я–Ъ) –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –њ–Њ–і–Ї–Њ–ґ–љ–∞—П –Є–љ—К–µ–Ї—Ж–Є—П –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –Ї–Њ–ї–Њ–љ–Є–µ—Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ (5 –Љ–≥/–Ї–≥ –і–≤–∞–ґ–і—Л –≤ –і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є), —Б–±–Њ—А –Љ–Њ–±–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –°–Ъ–Я–Ъ –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –љ–∞ 5-—Л–є –Є 6-–Њ–є –і–µ–љ—М –Ї—Г—А—Б–∞. –Э–µ–њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–µ –°–Ъ–Я–Ъ –Є –Ъ–Ь —Б–ї—Г–ґ–Є–ї–Є –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ 11-–Њ–є –Є 28-–Њ–є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –њ—А–Є —Н—В–Њ–Љ –≤ –≥—А—Г–њ–њ–µ 1 –Ъ–Ь –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—В–Њ—З–љ–Є–Ї–∞ —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ 2. –Ю–±–µ –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б—Е–Њ–ґ–Є–Љ–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Љ–Њ–Љ–µ–љ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є, —А–Њ–і—Б—В–≤–∞ –Є –њ–Њ–ї–∞ –і–Њ–љ–Њ—А–∞ –Є –њ–∞—Ж–Є–µ–љ—В–∞, –≥—А—Г–њ–њ –Ї—А–Њ–≤–Є –Є –¶–Ь–Т-—Б—В–∞—В—Г—Б–∞ –і–Њ–љ–Њ—А–∞ –Є —А–µ—Ж–Є–њ–Є–µ–љ—В–∞, –∞ —В–∞–Ї–ґ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —П–і–µ—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–µ.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ —А–µ–∞–Ї—Ж–Є–Є ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (n = 24) –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г —А–µ–∞–Ї—Ж–Є–Є ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї (–†–Ґ–Я–•) –њ—Г—В–µ–Љ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞—А–Є–љ–∞ –Р (–¶—Б –Р) –њ–Њ 3 –Љ–≥/–Ї–≥ –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Б 1 –і–љ—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є. –°–µ–Љ–µ—А–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ—Е–Њ–і–Є–ї–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –¶—Б –Р –Є –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В –Љ–Њ—Д–µ—В–Є–ї. –Ш–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –њ–Њ–і–≥–Њ—В–Њ–≤–Є—В–µ–ї—М–љ—Л–є —А–µ–ґ–Є–Љ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, 22 –њ–Њ–ї—Г—З–∞–ї–Є –Ї—А–Њ–ї–Є—З–Є–є –∞–љ—В–Є—В–Є–Љ–Њ—Ж–Є—В–∞—А–љ—Л–є –≥–ї–Њ–±—Г–ї–Є–љ (–Р–Ґ–У [40 –Љ–≥/–Ї–≥; —Д–∞—А–Љ. –Ї–Њ–Љ–њ–∞–љ–Є–Є –§—А–µ–Ј–µ–љ–Є—Г—Б, –С–∞–і-–•–Њ–Љ–±—Г—А–≥, –У–µ—А–Љ–∞–љ–Є—П] –Є–ї–Є —В–Є–Љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ –≤ —Б—Г–Љ–Љ–∞—А–љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 10 –Љ–≥/–Ї–≥). –Т –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ –њ—А–Є–Љ–µ–љ—П–ї—Б—П –њ—А–µ–њ–∞—А–∞—В –Ъ—Н–Љ–њ–∞—Б 1H, –∞ –≤ –і—А—Г–≥–Є—Е —В—А–µ—Е —Б–ї—Г—З–∞—П—Е –њ–∞—Ж–Є–µ–љ—В—Л –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є —Б–µ—А–Њ—В–µ—А–∞–њ–Є—О. –†–µ–ґ–Є–Љ—Л –±–µ–Ј —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –≤ 5 —Б–ї—Г—З–∞—П—Е –≤–Ї–ї—О—З–∞–ї–Є –Ї—Н–Љ–њ–∞—Б 1G –Є –≤ 2 —Б–ї—Г—З–∞—П—Е - –Р–Ґ–У (—В–∞–±–ї–Є—Ж–∞ II).–°–µ—А–Њ—В–µ—А–∞–њ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б —З–µ—В–≤–µ—А—В–Њ–≥–Њ –і–љ—П –њ–Њ –њ–µ—А–≤—Л–є –≤ –Ї–∞—З–µ—Б—В–≤–µ —З–∞—Б—В–Є —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П.
–Я–∞—Ж–Є–µ–љ—В—Л, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ—А–Њ—П–≤–ї—П–ї–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –†–Ґ–Я–•, –њ–Њ–ї—Г—З–∞–ї–Є –¶—Б–Р –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, 3 –Љ–µ—Б—П—Ж–µ–≤, –∞ –Ј–∞—В–µ–Љ –Ї—Г—А—Б –њ—А–µ–Ї—А–∞—Й–∞–ї—Б—П. –Э–∞–ї–Є—З–Є–µ –Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –†–Ґ–Я–• (–Њ–†–Ґ–Я–• –Є —Е–†–Ґ–Я–•) –Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤.[20] –Я—А–Є –њ–µ—А–≤–Њ–Љ –ґ–µ –њ–Њ—П–≤–ї–µ–љ–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –†–Ґ–Я–•, –њ–∞—Ж–Є–µ–љ—В–∞–Љ –љ–µ–Ј–∞–Љ–µ–і–ї–Є—В–µ–ї—М–љ–Њ –≤–≤–Њ–і–Є–ї—Б—П –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ (2 –Љ–≥/–Ї–≥) –Є –¶—Б–Р.
–Я–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П —В–µ—А–∞–њ–Є—П –Є –∞–љ–∞–ї–Є–Ј –љ–∞ —Е–Є–Љ–µ—А–Є–Ј–Љ
–Т –њ—А–Њ—Ж–µ—Б—Б–µ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є —В—А–Є–Љ–µ—В–Њ–њ—А–Є–Љ/ - —Б—Г–ї—М—Д–∞–Љ–µ—В–Њ–Ї—Б–∞–Ј–Њ–ї, –∞—Ж–Є–Ї–ї–Њ–≤–Є—А –Є –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї. –Я–∞—Ж–Є–µ–љ—В—Л –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–∞–ї–∞—В–∞—Е, –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–љ–Њ–є –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Ј–∞–і–µ—А–ґ–Є–≤–∞—О—Й–µ–Љ —З–∞—Б—В–Є—Ж—Л HEPA - —Д–Є–ї—М—В—А–Њ–Љ –Є –њ–Њ–ї—Г—З–∞–ї–Є —А–µ–≥—Г–ї—П—А–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ. –Ф—А—Г–≥–Є–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –Љ–µ—А—Л, —В–∞–Ї–Є–µ, –Ї–∞–Ї –њ–Њ–ї–љ–Њ–µ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ –Є –њ–µ—А–µ–ї–Є–≤–∞–љ–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ї—А–Њ–≤–Є, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є—Б—М –њ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є. –Р–љ–∞–ї–Є–Ј –љ–∞ –¶–Ь–Т - –∞–љ—В–Є–≥–µ–љ–µ–Љ–Є—О (pp65) –Є–ї–Є –Я–¶–† (–њ–Њ–ї–Є–Љ–µ—А–∞–Ј–љ—Г—О —Ж–µ–њ–љ—Г—О —А–µ–∞–Ї—Ж–Є—О) –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –Ї–∞–ґ–і—Г—О –љ–µ–і–µ–ї—О, –Є –≤ —Б–ї—Г—З–∞–µ —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –љ–∞—З–Є–љ–∞–ї–∞—Б—М –њ—А–µ–≤–µ–љ—В–Є–≤–љ–∞—П –∞–љ—В–Є–≤–Є—А—Г—Б–љ–∞—П —В–µ—А–∞–њ–Є—П.
–Ю—Ж–µ–љ–Ї–∞ —Б—В–µ–њ–µ–љ–Є —Е–Є–Љ–µ—А–Є–Ј–Љ–∞ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ –њ—Г—В–µ–Љ –Њ—В—Б–ї–µ–ґ–Є–≤–∞–љ–Є—П –і–Њ–љ–Њ—А –Є —Е–Њ–Ј—П–Є–љ вАУ —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л—Е –Ф–Э–Ъ-–Љ–∞—А–Ї–µ—А–Њ–≤ —Б –њ–Њ–Љ–Њ—Й—М—О –∞–љ–∞–ї–Є–Ј–∞ –Ї–Њ—А–Њ—В–Ї–Є—Е —В–∞–љ–і–µ–Љ–љ—Л—Е –њ–Њ–≤—В–Њ—А–Њ–≤ (–Љ–µ—В–Њ–і –Њ—Ж–µ–љ–Ї–Є —Б—В–µ–њ–µ–љ–Є —Е–Є–Љ–µ—А–Є–Ј–Љ–∞ –Љ–µ–љ—П–µ—В—Б—П –Є–Ј –≥–Њ–і–∞ –≤ –≥–Њ–і).
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л
–°–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –і–≤—Г—Е –Ї–∞—В–µ–≥–Њ—А–Є–∞–ї—М–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —В–Њ—З–љ–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П –§–Є—И–µ—А–∞. –°—А–∞–≤–љ–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ t-–Ї—А–Є—В–µ—А–Є—П –Є–ї–Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞-–£–Є—В–љ–Є (M-W). –Т—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —А–∞—Б—З–Є—В—Л–≤–∞–ї–∞—Б—М –њ–Њ –Љ–µ—В–Њ–і—Г –Ъ–∞–њ–ї–∞–љ–∞-–Ь–µ–є–µ—А–∞, –∞ —Б—А–∞–≤–љ–µ–љ–Є–µ –Ї—А–Є–≤—Л—Е –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г –њ–Њ–і–≥—А—Г–њ–њ–∞–Љ–Є вАУ —Б –њ–Њ–Љ–Њ—Й—М—О –ї–Њ–≥—А–∞–љ–≥–Њ–≤–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П. –†–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–∞—П –Љ–Њ–і–µ–ї—М –Ъ–Њ–Ї—Б–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –і–ї—П –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –≤–ї–Є—П–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є (–Ю–Т). –Т—Б–µ –њ—А–Є–Љ–µ–љ–µ–љ–љ—Л–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л —П–≤–ї—П–ї–Є—Б—М –і–≤—Г—Е–≤—Л–±–Њ—А–Њ—З–љ—Л–Љ–Є, —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–є —Б—З–Є—В–∞–ї–∞—Б—М –†-–≤–µ–ї–Є—З–Є–љ–∞ –Љ–µ–љ—М—И–∞—П –Є–ї–Є —А–∞–≤–љ–∞—П 0. 05.
–Ґ–Р–С–Ы–Ш–¶–Р II. –Я—А–Њ—В–Њ–Ї–Њ–ї –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П
a–†–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–є –≤ —Е–Њ–і–µ –≤—В–Њ—А–Њ–є –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є. –Ъ—Н–Љ–њ–∞—Б 1G = 4 –Љ–≥/–Ї–≥, –Љ–Є—В–Њ–Ї—Б–∞–љ—В—А–Њ–љ = 10 –Љ–≥/–Љ2, –Ї—Н–Љ–њ–∞—Б 1H = 0.8 –Љ–≥/–Ї–≥. –С–£, –±—Г—Б—Г–ї—М—Д–∞–љ (12.8 –Љ–≥/–Ї–≥); –¶–§, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і (200 –Љ–≥/–Љ2); TT, —В–Є–Њ—В–µ–њ–∞ (10 –Љ–≥/–Ї–≥); –¶–§, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і (60 –Љ–≥/–Ї–≥); –Ґ–Ю–Ґ, —В–Њ—В–∞–ї—М–љ–Њ–µ –Њ–±–ї—Г—З–µ–љ–Є–µ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ (1200 —А–∞–і); –Р–Ґ–У, —В–Є–Љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ (10 –Љ–≥/–Ї–≥) –Є–ї–Є –Р–Ґ–У (–§—А–µ–Ј–µ–љ–Є—Г—Б) (40 –Љ–≥/–Ї–≥); –Я–Ґ–Т–•, —А–µ–∞–Ї—Ж–Є—П ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї; –¶—Б–Р, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ A; –Ь–Ь–§, –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В –Љ–Њ—Д–µ—В–Є–ї; –§–Ы–£, —Д–ї—Г–і–∞—А–∞–±–Є–љ (180 –Љ–≥/–Љ2); –Ь–Х–Ы, –Љ–µ–ї—Д–∞–ї–∞–љ (70 –Љ–≥/–Љ2); –Ґ–†–Х–Ю, —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ (12 –≥/–Љ2, –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–ї–∞–і—И–µ 1 –≥–Њ–і–∞; 14 –≥/–Љ2, –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 1 –≥–Њ–і–∞).
[nextpage title="–†–Х–Ч–£–Ы–ђ–Ґ–Р–Ґ–Ђ"]
–Я—А–Є–ґ–Є–≤–ї–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –Њ–†–Ґ–Я–• –Є —Е–†–Ґ–Я–•
–Т –≥—А—Г–њ–њ–µ —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –±–µ–Ј —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ (–≥—А—Г–њ–њ–∞ 1), –Љ–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –і–Њ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (–Р–І–Э –≤—Л—И–µ 0.5 √Ч 109/–ї –≤ —В–µ—З–µ–љ–Є–µ 3-–µ—Е –і–љ–µ–є –њ–Њ–і—А—П–і) —Б–Њ—Б—В–∞–≤–Є–ї–∞ 23 –і–љ—П (–Њ—В 20 –і–Њ 32 –і–љ–µ–є), –∞ –≤ –≥—А—Г–њ–њ–µ —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ (–≥—А—Г–њ–њ–∞ 2) - 19 –і–љ–µ–є (–Њ—В 10 –і–Њ 53), —Е–Њ—В—П —А–∞–Ј–љ–Є—Ж–∞ –љ–µ –і–Њ—Б—В–Є–≥–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є (–†- –≤–µ–ї–Є—З–Є–љ–∞ = 0.199 (MвАУW) (–†–Є—Б. 1). –Ь–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –±–Њ–ї–µ–µ 20 √Ч 109/–ї —Б–Њ—Б—В–∞–≤–Є–ї–∞ 48 –і–љ–µ–є (–Њ—В 25 –і–Њ 75) –≤ –≥—А—Г–њ–њ–µ 1 –Є 33.5 –і–љ–µ–є (–Њ—В 9 –і–Њ 64) –≤ –≥—А—Г–њ–њ–µ 2, —Г—А–Њ–≤–µ–љ—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є P = 0.01 (MвАУW), –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2.
–Ш–Ј –≤—Б–µ–є –≤—Л–±–Њ—А–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В–Њ–ї—М–Ї–Њ —Г 4 —А–∞–Ј–≤–Є–ї–∞—Б—М –†–Ґ–Я–• 2-3 —Б—В–µ–њ–µ–љ–Є, –∞ —Г 2 –Є–Ј –љ–Є—Е —А–µ–∞–Ї—Ж–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–∞ –≤ –ї–Є–Љ–Є—В–Є—А–Њ–≤–∞–љ–љ—Г—О —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –†–Ґ–Я–•.
–У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П –Є –Т–Ю–С –њ–µ—З–µ–љ–Є
–Ф–∞–љ–љ—Л–µ –њ–Њ –њ–Њ—Б—В—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Њ–љ–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О –Ї–∞–ї—М—Ж–Є—П –±—Л–ї–Є –і–Њ—Б—В—Г–њ–љ—Л –і–ї—П 22 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј –≥—А—Г–њ–њ—Л 2. –Ш–Ј –љ–Є—Е —Г 14 (63%) —Г—А–Њ–≤–µ–љ—М —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П –њ—А–µ–≤—Л—И–∞–ї 2.55 –Љ–Љ–Њ–ї—М/–ї (–љ–Њ—А–Љ–∞–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М—Ж–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 2.15вАУ2.55 –Љ–Љ–Њ–ї—М/–ї). –Я–µ—А–≤—Л–є –њ–Њ–і—К–µ–Љ —Г—А–Њ–≤–љ—П –Ї–∞–ї—М—Ж–Є—П –±—Л–ї –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –≤ —Б—А–µ–і–љ–µ–Љ —Б–њ—Г—Б—В—П 19.5 –і–љ–µ–є –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є (–Њ—В 2 –і–Њ 172 –і–љ–µ–є). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–µ–є –њ–Њ–ї—Г—З–∞–ї–Є –ї–µ—З–µ–љ–Є–µ —Б–Њ–≥–ї–∞—Б–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–Љ—Г –њ—А–Њ—В–Њ–Ї–Њ–ї—Г, –≤–Ї–ї—О—З–∞—П –≥–Є–і—А–∞—В–∞—Ж–Є—О, –≤—Л–љ—Г–ґ–і–µ–љ–љ—Л–є –і–Є—Г—А–µ–Ј —Д—Г—А–Њ—Б–µ–Љ–Є–і–Њ–Љ, –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ –Є —Б—В–µ—А–Њ–Є–і—Л. –С–Є—Б—Д–Њ—Д–Њ–љ–∞—В—Л –љ–µ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М. –У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ —Г—Б—В—А–∞–љ–µ–љ–∞ –±–µ–Ј –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Ч–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Т–Ю–С –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 1 (7 –Є–Ј 12 –њ–∞—Ж–Є–µ–љ—В–Њ–≤), —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ 2 (3 –Є–Ј 25 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) (P = 0.009). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Т–Ю–С –≤—Л–ґ–Є–ї–Є. –Ф–µ—Д–Є–±—А–Њ—В–Є–і –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Т–Ю–С –љ–µ –њ—А–Є–Љ–µ–љ—П–ї—Б—П.
–Э–µ–Њ–±—Л—З–љ—Л–Љ —П–≤–Є–ї–Њ—Б—М —В–Њ, —З—В–Њ —В–Њ–ї—М–Ї–Њ —Г –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Є–Ј –≤—Б–µ—Е (–≤ –≥—А—Г–њ–њ–µ 2) —А–∞–Ј–≤–Є–ї–∞—Б—М –ї–µ–≥–Њ—З–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П. –Ф–∞–љ–љ—Л—Е –њ–Њ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Є–Ј –≥—А—Г–њ–њ—Л 1 –љ–µ –њ–Њ—Б—В—Г–њ–∞–ї–Њ.
–†–Є—Б. 1. –Т–µ—А–Њ—П—В–љ–Њ—Б—В–љ–∞—П –Ї—А–Є–≤–∞—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Р–І–Э > 0.5 √Ч 109/–ї –≤ –ї–µ—З–µ–±–љ—Л—Е –≥—А—Г–њ–њ–∞—Е. –Ь–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 23 –і–љ—П –≤ –≥—А—Г–њ–њ–µ 1 –Є 19 –і–љ–µ–є –≤ –≥—А—Г–њ–њ–µ 2, —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –љ–µ –і–Њ—Б—В–Є–≥–љ—Г—В–∞.
–†–Є—Б. 2. –Т–µ—А–Њ—П—В–љ–Њ—Б—В–љ–∞—П –Ї—А–Є–≤–∞—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —З–Є—Б–ї–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ > 20 √Ч 109/–ї –≤ –ї–µ—З–µ–±–љ—Л—Е –≥—А—Г–њ–њ–∞—Е. –Ь–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 48 –і–љ–µ–є –≤ –≥—А—Г–њ–њ–µ 1 –Є 33.5 –і–љ—П –≤ –≥—А—Г–њ–њ–µ 2 , —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –і–Њ—Б—В–Є–≥–љ—Г—В–∞.
–†–Є—Б. 3. –Т–µ—А–Њ—П—В–љ–Њ—Б—В–љ–∞—П –Ї—А–Є–≤–∞—П –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ. –Ш–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л–ґ–Є–ї–Є 32 (84 %), —Б—А–µ–і–љ—П—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –≤—А–µ–Љ–µ–љ–Є –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 684 –і–љ—П, –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 2 (96%). –Т –≥—А—Г–њ–њ–µ 2 —Г–Љ–µ—А –Њ–і–Є–љ –њ–∞—Ж–Є–µ–љ—В, –≤ –≥—А—Г–њ–њ–µ 1 - –њ—П—В–µ—А–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Т—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–µ–Ј –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Є –Ю–Т
–Ш–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, 32 (84 %) –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –ґ–Є–≤—Л –≤ —В–µ—З–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П 684 –і–љ—П, –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 2 (96 %) (—Б—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П 202 –і–љ—П, 123 - 4 906 –і–љ–µ–є), –∞ –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ 1 —Б–Њ—Б—В–∞–≤–Є–ї–∞ 58 % (—Б—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П 672 –і–љ—П, 291 вАУ 10 683 –і–љ—П). –Ч–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ —В–Њ–ї—М–Ї–Њ –Њ–і–Є–љ –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і –≤ –≥—А—Г–њ–њ–µ 2 (—Г –і–µ–≤–Њ—З–Ї–Є 6-—В–Є –ї–µ—В, –њ—А–Њ—Е–Њ–і–Є–≤—И–µ–є –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О, —А–∞–Ј–≤–Є–ї–Њ—Б—М –њ–µ—А–≤–Є—З–љ–Њ–µ –љ–µ–њ—А–Є–ґ–Є–≤–ї–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞) –Є 5 –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ –≥—А—Г–њ–њ–µ 1 (P = 0.004). –Т –≥—А—Г–њ–њ–µ 1 –і–≤–Њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г–Љ–µ—А–ї–Є –њ–Њ –њ—А–Є—З–Є–љ–µ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –љ–µ–њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –њ—А–Є—З–Є–љ–∞ —Б–Љ–µ—А—В–Є —В—А–µ—Е –і—А—Г–≥–Є—Е –і–µ—В–µ–є вАУ –Т–Ю–С –Є –Є–љ—Д–µ–Ї—Ж–Є–Є. –Р–љ–∞–ї–Є–Ј –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–Њ –Љ–µ—В–Њ–і—Г –Ъ–∞–њ–ї–∞–љ–∞-–Ь–µ–є–µ—А–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–∞ —А–Є—Б. 3.
–°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —А–Є—Б–Ї–Њ–≤ (HR) –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –њ–Њ–і—Б—З–Є—В–∞–љ–Њ —Б –њ–Њ–Љ–Њ—Й—М—О —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–є –Љ–Њ–і–µ–ї–Є –Ъ–Њ–Ї—Б–∞, —Б —Г—З–µ—В–Њ–Љ –≤–ї–Є—П–љ–Є—П –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞ –Љ–Њ–Љ–µ–љ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ъ–Ь –Є –і–Њ–љ–Њ—А—Б–Ї–Њ–є —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є –љ–∞ –Ї–Њ–љ–µ—З–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В –њ—А–Њ—Ж–µ–і—Г—А—Л. –Ю–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 2; –≤ –≥—А—Г–њ–њ–µ 1 —А–Є—Б–Ї –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ, HR = 97. 627 (–і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї 95 % 3.104-3073.440, P = 0.009). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤—Б–µ –≤—Л–ґ–Є–≤—И–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л –≤ –≥—А—Г–њ–њ–µ 1 –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є 100 % –і–Њ–љ–Њ—А—Б–Ї–Є–є —Е–Є–Љ–µ—А–Є–Ј–Љ, –∞ –≤ –≥—А—Г–њ–њ–µ 2 (—Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞), 14 –і–µ—В–µ–є –њ–Њ–Ї–∞–Ј–∞–ї–Є –њ–Њ–ї–љ—Л–є –і–Њ–љ–Њ—А—Б–Ї–Є–є —Е–Є–Љ–µ—А–Є–Ј–Љ, 8 - —Б—В–∞–±–Є–ї—М–љ—Л–є —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–Є–Љ–µ—А–Є–Ј–Љ (42-97 % –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї), –∞ —Г –і–≤–Њ–Є—Е —А–∞–Ј–≤–Є–ї–Њ—Б—М –≤—В–Њ—А–Є—З–љ–Њ–µ –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞ –њ–Њ—Б–ї–µ —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П (–≤ –њ–µ—А–≤–Њ–Љ —Б–ї—Г—З–∞–µ, –Ї–∞–Ї —Г–њ–Њ–Љ–Є–љ–∞–ї–Њ—Б—М —А–∞–љ–µ–µ, –њ–Њ—Б–ї–µ –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–є –Ґ–У–°–Ъ, –њ–∞—Ж–Є–µ–љ—В —Г—Б–њ–µ—И–љ–Њ –њ–µ—А–µ–љ–µ—Б –≤—В–Њ—А–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —В–Њ–≥–Њ –ґ–µ –і–Њ–љ–Њ—А–∞, –∞ –≤–Њ –≤—В–Њ—А–Њ–Љ —Б–ї—Г—З–∞–µ —Б–µ–Љ—М—П –Њ—В–Ї–∞–Ј–∞–ї–∞—Б—М –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –ї–µ—З–µ–љ–Є–µ). –Ф–∞–љ–љ—Л–µ —Е–Є–Љ–µ—А–Є–Ј–Љ–∞ –њ–Њ –і–≤—Г–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Є –љ–µ–і–Њ—Б—В—Г–њ–љ—Л. –°—В–∞–±–Є–ї—М–љ—Л–є —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–Є–Љ–µ—А–Є–Ј–Љ (63-88 % –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї) –љ–∞–±–ї—О–і–∞–ї—Б—П —Г –і–≤—Г—Е –Є–Ј 8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ–∞ –Є —В–Є–Њ—В–µ–њ—Л.
[nextpage title="–Ю–С–°–£–Ц–Ф–Х–Э–Ш–Х –Ш –С–Ы–Р–У–Ю–Ф–Р–†–Э–Ю–°–Ґ–Ш"]
–Ѓ–≤–µ–љ–Є–ї—М–љ—Л–є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј (–Ѓ–Ч–Ю) вАУ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –љ–µ–Є–Ј–±–µ–ґ–љ–Њ —П–≤–ї—П–µ—В—Б—П —Б–Љ–µ—А—В–µ–ї—М–љ—Л–Љ, –µ—Б–ї–Є –ї–µ—З–µ–љ–Є–µ –љ–µ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤–Њ–≤—А–µ–Љ—П. –Ґ–У–°–Ъ вАУ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є —А–∞–і–Є–Ї–∞–ї—М–љ—Л–є –Љ–µ—В–Њ–і –ї–µ—З–µ–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ґ—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–Њ–Ї–∞–Ј–∞–ї–∞ —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –ї–µ—З–µ–љ–Є–Є –Ѓ–Ч–Ю —Г –Љ—Л—И–µ–є, —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–∞ —Б–Њ—Е—А–∞–љ–µ–љ–Є—О –Ј—А–µ–љ–Є—П –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –≥–µ–Љ–Њ–њ–Њ—Н–Ј–∞, –µ—Б–ї–Є –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –њ–Њ—Б–ї–µ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –±—Г—Б—Г–ї—М—Д–∞–љ–∞.[21,22] –Я–µ—А–≤—Л–µ –њ—А–Њ—Ж–µ–і—Г—А—Л –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ѓ–Ч–Ю —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—А–Њ–≤–µ–і–µ–љ—Л –і-—А–Њ–Љ –С–∞–ї–ї–µ—В–Њ–Љ —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є –≤ 1977 –≥–Њ–і—Г –Є –і-—А–Њ–Љ –Ъ–Њ—З—З–Є–∞ –≤ 1980 –≥. [23,24] –Х–і–Є–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–ї–Њ [15], –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –њ—А–∞–Ї—В–Є–Ї–∞ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В—А–∞–љ –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е —Ж–µ–љ—В—А–Њ–≤. –†–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –±—Л–ї –≤–≤–µ–і–µ–љ –≤ –њ—А–∞–Ї—В–Є–Ї—Г –≤ —Б–µ—А–µ–і–Є–љ–µ 90-—Е –≥–Њ–і–Њ–≤ 20 –≤–µ–Ї–∞. –С—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –і–Њ–Ї–ї–∞–і—Л –Њ –њ–µ—А–≤—Л—Е —Б–ї—Г—З–∞—П—Е –Є, –њ–Њ–Ј–і–љ–µ–µ, –±–Њ–ї–µ–µ –Љ–∞—Б—И—В–∞–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Њ–њ–Є—Б—Л–≤–∞–≤—И–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –і–∞–љ–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –≤ –ї–µ—З–µ–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. [25вАУ31] –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –ї–Є—И—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ґ–У–°–Ъ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ѓ–Ч–Ю.
–Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і–Њ–Ї–ї–∞–і–∞—Е –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ї—А–Њ–≤–Є –Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (EBMT) —Б–Њ–і–µ—А–ґ–∞—В—Б—П –і–∞–љ–љ—Л–µ –њ–Њ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±–µ–Ј –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П (–Т–С–Я), —А–∞–≤–љ–Њ–є 73-79 % –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В –°–†–Ф, –∞ –њ—А–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ —А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ, —А–∞–≤–љ–Њ–є 38-43 %. [15,32]
–Э–µ–і–∞–≤–љ–Њ –±—Л–ї–Є —Б–Њ–±—А–∞–љ—Л –і–∞–љ–љ—Л–µ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є —Г 125 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю –њ—А–Є —Г—З–∞—Б—В–Є–Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ (ESID) –Є –†–∞–±–Њ—З–µ–є –≥—А—Г–њ–њ–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є EBMT (IEWPвАУEBMT). –Я—П—В–Є–ї–µ—В–љ—П—П –Т–С–Я –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г 88 % —А–µ—Ж–Є–њ–Є–µ–љ—В–Њ–≤ –њ—А–Є HLA-–Є–і–µ–љ—В–Є—З–љ–Њ–є –Ґ–У–°–Ъ, 80 % - –њ—А–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В HLA-—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ, –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞ –Є 66 % - –њ—А–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В HLA-–≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞.[33] –Т –і—А—Г–≥–Њ–Љ –і–Њ–Ї–ї–∞–і–µ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є 193 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –≥–і–µ –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В 62 % –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В HLA-—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ —Б–Є–±–ї–Є–љ–≥–∞ –Є 42 % - –њ–Њ—Б–ї–µ –і—А—Г–≥–Є—Е, –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е –≤–Є–і–Њ–≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є. [34] –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –±—Г—Б—Г–ї—М—Д–∞–љ–∞ –Є —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–∞.
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б—В–∞–љ–і–∞—А—В–љ—Л–є –њ—А–Њ—В–Њ–Ї–Њ–ї –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Є –Ґ–У–°–Ъ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї—Б—П —Б –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–±–Њ–ї—М—И–Є—Е –Њ–і–љ–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —А–µ–ґ–Є–Љ–Њ–≤ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О, —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Т 2006 –≥–Њ–і—Г –і-—А –Ґ–Њ–ї–∞—А —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є —Б–Њ–Њ–±—Й–∞–ї–Є –Њ 55 % –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —Б—А–µ–і–Є 11 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є –Ґ–У–°–Ъ –њ–Њ —А–µ–ґ–Є–Љ–∞–Љ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О.[17]
–Т –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –Њ–і–љ–∞ –≥—А—Г–њ–њ–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –Ґ–У–°–Ъ –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ —Ж–µ–љ—В—А–µ ¬Ђ–•–∞–і–∞—Б—Б–∞¬ї –≤ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–µ 30, –Є —Б—А–∞–≤–љ–Є–≤–∞—О—В—Б—П —Б—В–∞–љ–і–∞—А—В–љ—Л–µ —А–µ–ґ–Є–Љ—Л –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–Њ –Ї–Њ–љ—Ж–∞ 90-—Е –≥–Њ–і–Њ–≤, —Б –љ–Њ–≤—Л–Љ —А–µ–ґ–Є–Љ–Њ–Љ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –±—Л–ї –≤–≤–µ–і–µ–љ –≤ –њ—А–∞–Ї—В–Є–Ї—Г —Б 1998 –≥–Њ–і–∞. –Э–Є–ґ–µ –њ—А–Є–≤–Њ–і—П—В—Б—П –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Ж–µ–љ–љ—Л–µ –љ–∞–±–ї—О–і–µ–љ–Є—П, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Т–Ю–С —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ґ–У–°–Ъ. –£ –і–µ—В–µ–є —Б –Ѓ–Ч–Ю, –њ–µ—А–µ–љ–µ—Б—И–Є—Е —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –і–∞–љ–љ–Њ–≥–Њ –Њ–њ–∞—Б–љ–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –Т–Ю–С –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –њ—Г—В–µ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–µ—Д–Є–±—А–Њ—В–Є–і–∞.[16] –Ю–±–љ–∞—А—Г–ґ–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є—В–Є—П –Т–Ю–С —Г –і–µ—В–µ–є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞.
–У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П вАУ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–µ –њ–Њ—Б—В—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Њ–љ–љ–Њ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю. [1,2,8,15,35,36] –Я–Њ –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –≤–∞—А—М–Є—А—Г–µ—В—Б—П –Њ—В 16 –і–Њ 40 % [15,36,37] –Т —Е–Њ–і–µ –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–Њ—Б—В—Г–њ–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П —А–∞–Ј–≤–Є–ї–∞—Б—М —Г 78 % –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 19.5 –і–љ–µ–є –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є (–Њ—В 2 –і–Њ 172 –і–љ–µ–є). –°—В–Њ–ї—М –≤—Л—Б–Њ–Ї–∞—П –њ—А–Њ—П–≤–ї–µ–љ–љ–Њ—Б—В—М –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П —В–µ–Љ, —З—В–Њ –≤–µ—А—Е–љ–Є–є –њ—А–µ–і–µ–ї –љ–Њ—А–Љ—Л –Ї–∞–ї—М—Ж–Є—П, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–є –≤ –љ–∞—И–µ–Љ —Ж–µ–љ—В—А–µ (2.55 –Љ–Љ–Њ–ї—М/–ї; 10.3 –Љ–≥/–і–ї) –љ–Є–ґ–µ, —З–µ–Љ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л–µ –≥—А–∞–љ–Є—Ж—Л (10.8вАУ11.5 –Љ–≥/–і–ї).[15,36,37] –Ф-—А –Ь–∞—А—В–Є–љ–µ–Ј —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є [36] –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–µ–є –Є —В–Є–њ–Њ–Љ –і–Њ–љ–Њ—А—Б–Ї–Њ–≥–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –њ–µ—А–µ—Б–∞–ґ–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В—М—О –њ–Њ HLA –Є–ї–Є —З–Є—Б–ї–Њ–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–є. –Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є –±—Л–ї —Б—В–∞—А—И–Є–є –≤–Њ–Ј—А–∞—Б—В —А–µ–±–µ–љ–Ї–∞ –љ–∞ –Љ–Њ–Љ–µ–љ—В –Ґ–У–°–Ъ. –Э–µ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Ґ–У–°–Ъ –Є –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–µ–є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤—Б–µ –љ–∞—И–Є –њ–∞—Ж–Є–µ–љ—В—Л, –Ї—А–Њ–Љ–µ –і–≤–Њ–Є—Е –Є–Ј –≥—А—Г–њ–њ—Л 2, –њ–µ—А–µ–љ–µ—Б–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 2-—Е –ї–µ—В. –°—Г—Й–µ—Б—В–≤—Г–µ—В –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –≤–∞—А–Є–∞–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Є–±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ–Є —П–≤–ї—П–µ—В—Б—П –≥–Є–і—А–∞—В–∞—Ж–Є—П –Є –њ–µ—В–ї–µ–≤—Л–µ –і–Є—Г—А–µ—В–Є–Ї–Є. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—А—Л –≤–Ї–ї—О—З–∞—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤, –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞, –±–Є—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤, —Б –њ–µ—А–µ–Љ–µ–љ–љ—Л–Љ —Г—Б–њ–µ—Е–Њ–Љ –ї–µ—З–µ–љ–Є—П. [33,35вАУ37] –Я—А–µ–њ–∞—А–∞—В –і–µ–љ–Њ—Б—Г–Љ–∞–± (–Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ–Њ–µ –∞–љ—В–Є—В–µ–ї–Њ –Ї RANKL), –љ–∞–Є–±–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є —Б–њ–Њ—Б–Њ–± –ї–µ—З–µ–љ–Є—П —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –Є —В—А—Г–і–љ–Њ–Є–Ј–ї–µ—З–Є–Љ–Њ–є –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є, –±—Л—Б—В—А–Њ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М—Ж–Є—П —Г –±–Њ–ї—М–љ—Л—Е .[33,38] –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П –±—Л–ї–∞ —Г—Б–њ–µ—И–љ–Њ —Г—Б—В—А–∞–љ–µ–љ–∞ –±–ї–∞–≥–Њ–і–∞—А—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤—Л–љ—Г–ґ–і–µ–љ–љ–Њ–≥–Њ –і–Є—Г—А–µ–Ј–∞, –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞ –Є —Б—В–µ—А–Њ–Є–і–Њ–≤.
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —А–∞–Ј–ї–Є—З–Є–є –≤ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, –Њ–і–љ–∞–Ї–Њ –≤—А–µ–Љ—П –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —З–Є—Б–ї–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, —А–∞–≤–љ–Њ–≥–Њ 20,000 –±—Л–ї–Њ –Љ–µ–љ—М—И–µ –≤ –≥—А—Г–њ–њ–µ —А–µ–ґ–Є–Љ–∞ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є, –±–µ–Ј –Ї–∞–Ї–Њ–≥–Њ-–ї–Є–±–Њ —Б–љ–Є–ґ–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ю–Т –Є–ї–Є –Т–С–Я. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, 8 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ —А–µ–ґ–Є–Љ—Г –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–є —Б—В–∞–±–Є–ї—М–љ—Л–є —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–Є–Љ–µ—А–Є–Ј–Љ –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ф–∞–љ–љ—Л–є —Д–µ–љ–Њ–Љ–µ–љ –±—Л–ї –Њ–њ–Є—Б–∞–љ –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Њ—В—З–µ—В–∞—Е –њ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—О –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ–Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є,[39] –Є –љ—Г–ґ–і–∞–µ—В—Б—П –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Є–Ј—Г—З–µ–љ–Є–Є.
–Ч–љ–∞—З–µ–љ–Є–µ –Р–Ґ–У –≤ —А–µ–ґ–Є–Љ–∞—Е –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ –і–Њ –Ї–Њ–љ—Ж–∞. –Р–Ґ–У –≤—Л–Ј—Л–≤–∞–µ—В –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є—О —Г —А–µ—Ж–Є–њ–Є–µ–љ—В–∞, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П —Г–ї—Г—З—И–µ–љ–Є—О –њ—А–Є–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –Є –Њ—Б—В–∞–µ—В—Б—П –≤ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є, –≤—Л–Ј—Л–≤–∞—П —З–∞—Б—В–Є—З–љ—Г—О –і–µ–њ–ї–µ—Ж–Є—О in vivo –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ґ-–Ї–ї–µ—В–Њ–Ї, –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О –Ј–∞—Й–Є—В—Г –Њ—В –†–Ґ–Я–•.[40вАУ42] –Т —Е–Њ–і–µ –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 22 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, –њ–Њ–ї—Г—З–∞–ї–Є —Б–µ—А–Њ—В–µ—А–∞–њ–Є—О –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –Ї –њ—А–Њ—Ж–µ–і—Г—А–µ, –њ—А–Є —Н—В–Њ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –њ–Њ—Б—В—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М.
–Ь—Л –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–Є–Ј–Ї—Г—О —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –†–Ґ–Я–• —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т–Њ–Ј–Љ–Њ–ґ–љ–∞—П –њ—А–Є—З–Є–љ–∞ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –Љ–љ–Њ–≥–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В –њ–Њ–ї–љ–Њ—Б—В—М—О –°–†–Ф, –∞ —В–∞–Ї–ґ–µ –±—Л–ї–Є –њ—А–Є–љ—П—В—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—А—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –†–Ґ–Я–•.
–Ю–Т –≤—Б–µ–є –Ї–Њ–≥–Њ—А—В—Л –Є–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 84 %, –њ—А–Є—З–µ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М (96 %) –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Я–Њ–≤—Л—И–µ–љ–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П —Б–љ–Є–ґ–µ–љ–љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О, –∞ —В–∞–Ї–ґ–µ —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В, —З—В–Њ –њ—А–Є–≤–µ–ї–Њ –Ї —Г–ї—Г—З—И–µ–љ–Є—О —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –Є —Б–љ–Є–ґ–µ–љ–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є.
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –µ–і–Є–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ ESID –Є IEWPвАУEBMT, –њ—А–Є–Ј—Л–≤–∞—О—В –Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О —А–µ–ґ–Є–Љ–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ѓ–Ч–Ю –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –±—Г—Б—Г–ї—М—Д–∞–љ–∞. [33,43] –Ф–∞–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Г–ї—Г—З—И–µ–љ–Є—О –Є—Б—Е–Њ–і–Њ–≤ –Ґ–У–°–Ъ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є HLA-–≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є.[33]
–Ф–ї—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (18/26) —А–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Д–ї—Г–і–Њ—А–∞–±–Є–љ–∞ –Є –±—Г—Б—Г–ї—М—Д–∞–љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –±–µ–Ј –Є–Ј–Љ–µ—А–µ–љ–Є—П —Ж–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ–µ–є (—Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞—З–∞–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –ї–Є—И—М –љ–µ–і–∞–≤–љ–Њ), –љ–Њ —Б 2011 –≥–Њ–і–∞ —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Д–ї—Г–і–∞—А–∞–±–Є–љ–Њ–Љ –Є —В–Є–Њ—В–µ–њ–Њ–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –Ґ–У–°–Ъ –њ—А–Є –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е.[44] –Т –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, 8 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ—И–ї–Є –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –і–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —Е–Њ—А–Њ—И—Г—О –њ—А–Є–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –≤—Л—Б–Њ–Ї—Г—О –Т–С–Я –Є –љ–Є–Ј–Ї—Г—О —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ —Б –±—Г—Б—Г–ї—М—Д–∞–љ–Њ–Љ (—Б –Є–Ј–Љ–µ—А–µ–љ–Є–µ–Љ —Ж–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ—П–Љ–µ–є) –Є —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Б–µ—А–Њ—В–µ—А–∞–њ–Є–Є –Є —А–Њ–ї–Є —В–Є–Њ—В–µ–њ—Л –≤ —А–µ–ґ–Є–Љ–∞—Е –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –і–ї—П –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–С–Ы–Р–У–Ю–Ф–Р–†–Э–Ю–°–Ґ–Ш
–Ь—Л –±–ї–∞–≥–Њ–і–∞—А–Є–Љ –љ–∞—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –Є—Е —Б–µ–Љ—М–Є –Ј–∞ –і–Њ–≤–µ—А–Є–µ –Є –њ–Њ–і–і–µ—А–ґ–Ї—Г, –∞ —В–∞–Ї–ґ–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –Є –∞–і–Љ–Є–љ–Є—Б—В—А–∞—В–Є–≤–љ—Л–є –њ–µ—А—Б–Њ–љ–∞–ї –љ–∞—И–µ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П.
[nextpage title="–Ы–Ш–Ґ–Х–†–Р–Ґ–£–†–Р"]
|
–Ъ—А–∞—В–Ї–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П. –Ґ—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Є—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї (–Ґ–У–°–Ъ) –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П —О–≤–µ–љ–Є–ї—М–љ–Њ–≥–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ (–Ѓ–Ч–Ю), –Њ–і–љ–∞–Ї–Њ —Б–≤—П–Ј–∞–љ–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞. –Т –і–∞–љ–љ–Њ–є —Б—В–∞—В—М–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б—А–∞–≤–љ–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ–Њ–≥–Њ –љ–∞–Љ–Є –Њ–њ—Л—В–∞ –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ґ–У–°–Ъ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Ѓ–Ч–Ю. –Ь–µ—В–Њ–і–Њ–ї–Њ–≥–Є—П. –Т —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–µ–љ—Л 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 1 –Љ–µ—Б—П—Ж–∞ –і–Њ 6 –ї–µ—В, (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В вАУ –Њ–Ї–Њ–ї–Њ 8 –Љ–µ—Б—П—Ж–µ–≤), –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –∞–ї–ї–Њ–≥–µ–љ–љ—Г—О –Ґ–У–°–Ъ –≤ –љ–∞—И–µ–Љ –≥–Њ—Б–њ–Є—В–∞–ї–µ, –љ–∞—З–Є–љ–∞—П —Б 1983 –≥–Њ–і–∞. –Ъ–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –њ—А–Є–Љ–µ–љ—П–ї–Њ—Б—М –≤ 26 –Є–Ј 38 —Б–ї—Г—З–∞–µ–≤, –∞ –і—А—Г–≥–Є–µ —А–µ–ґ–Є–Љ—Л –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П - –≤ 12 –Є–Ј 38. –†–µ–Ј—Г–ї—М—В–∞—В—Л. –Ю–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 96 % (25 –Є–Ј 26) –њ—А–Њ—В–Є–≤ 58 % (7 –Є–Ј 12) –њ—А–Є –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е —А–µ–ґ–Є–Љ–∞—Е (P = 0.004), –њ—А–Є—З–µ–Љ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –≤–Ї–ї—О—З–∞—П –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—О –Є –≤–µ–љ–Њ–Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ—Г—О –±–Њ–ї–µ–Ј–љ—М –њ–µ—З–µ–љ–Є, –±—Л–ї–Є –њ—А–Њ—П–≤–ї–µ–љ—Л –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є. –Т—Б–µ –≤—Л–ґ–Є–≤—И–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л.
–Т—Л–≤–Њ–і—Л.
–Ь—Л –Ј–∞–Ї–ї—О—З–Є–ї–Є, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю –Є —Б–љ–Є–ґ–∞–µ—В –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М –≤ —Б–≤—П–Ј–Є —Б –Ґ–У–°–Ъ.
|
–Т–Т–Х–Ф–Х–Э–Ш–Х
–Р—Г—В–Њ—Б–Њ–Љ–љ–Њ-—А–µ—Ж–µ—Б—Б–Є–≤–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј, —В–∞–Ї–ґ–µ –Є–Ј–≤–µ—Б—В–љ—Л–є –Ї–∞–Ї —О–≤–µ–љ–Є–ї—М–љ—Л–є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј (–Ѓ–Ч–Ю), - —П—Б–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –і–ї—П –Ї–Њ—В–Њ—А–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–љ—Л –≤—Л—Б–Њ–Ї–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М. –Ф–∞–љ–љ–Њ–µ —А–µ–і–Ї–Њ–µ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б —З–∞—Б—В–Њ—В–Њ–є 1:200,000 - 1:300,000, –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ –Ъ–Њ—Б—В–∞-–†–Є–Ї–µ, —А–µ—Б–њ—Г–±–ї–Є–Ї–µ –І—Г–≤–∞—И–Є—П –≤ –†–Њ—Б—Б–Є–Є –Є –љ–∞ –°—А–µ–і–љ–µ–Љ –Т–Њ—Б—В–Њ–Ї–µ .[1вАУ5] –Ѓ–Ч–Ю —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Њ—Б–ї–∞–±–ї–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–µ–є –∞–љ–Њ–Љ–∞–ї—М–љ—Г—О —А–µ–Ј–Њ—А–±—Ж–Є—О –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л. –°–љ–Є–ґ–µ–љ–Є–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є –њ—А–Є–≤–Њ–і–Є—В –Ї –Є—Е –Њ—Б–ї–∞–±–ї–µ–љ–Є—О, –Ї–Њ—Б—В–Є —Б—В–∞–љ–Њ–≤—П—В—Б—П —Е—А—Г–њ–Ї–Є–Љ–Є –Є –њ–Њ–і–≤–µ—А–ґ–µ–љ–љ—Л–Љ–Є –њ–µ—А–µ–ї–Њ–Љ–∞–Љ.[6]
–Ѓ–Ч–Ю –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Г –і–µ—В–µ–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ –њ–µ—А–≤—Л–є –≥–Њ–і –ґ–Є–Ј–љ–Є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ—А–Є–±–∞–≤–Ї–Є –≤ –≤–µ—Б–µ, –Љ–∞–Ї—А–Њ—Ж–µ—Д–∞–ї–Є–µ–є –Є –≤—Л—Б—В—Г–њ–∞—О—Й–Є–Љ–Є –ї–Њ–±–љ—Л–Љ–Є –±—Г–≥—А–∞–Љ–Є. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П —З–µ—А–µ–њ–∞ –Љ–Њ–≥—Г—В –њ—А–Є–≤–µ—Б—В–Є –Ї –≥–Є–і—А–Њ—Ж–µ—Д–∞–ї–Є–Є –Є —Е–Њ–∞–љ–∞–ї—М–љ–Њ–Љ—Г —Б—В–µ–љ–Њ–Ј—Г. –Ъ –і—А—Г–≥–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—В–љ–Њ—Б—П—В—Б—П –Љ–Є–Ї—А–Њ–≥–љ–∞—В–Є—П (–љ–µ–і–Њ—А–∞–Ј–≤–Є—В–Є–µ —З–µ–ї—О—Б—В–µ–є), —Г–Ј–Ї–∞—П –≥—А—Г–і–љ–∞—П –Ї–ї–µ—В–Ї–∞, –њ–µ—А–µ–ї–Њ–Љ—Л, –≥–µ–њ–∞—В–Њ—Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є—П (–Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ–ї–µ–Ј–µ–љ–Ї–Є –Є –њ–µ—З–µ–љ–Є), –≥–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П, –і–µ—Д–µ–Ї—В—Л –њ—А–Є –њ—А–Њ—А–µ–Ј—Л–≤–∞–љ–Є–Є –Ј—Г–±–Њ–≤ –Є —Б–Є–ї—М–љ—Л–є –Ј—Г–±–љ–Њ–є –Ї–∞—А–Є–µ—Б.
–Я–∞—В–Њ–ї–Њ–≥–Є—П –Ї–Њ—Б—В–µ–є –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О —З–µ—А–µ–њ–љ—Л—Е –љ–µ—А–≤–Њ–≤, –њ—А–Є–≤–Њ–і—П—Й—Г—О –Ї —Б–ї–µ–њ–Њ—В–µ –Є –≥–ї—Г—Е–Њ—В–µ –Є–ї–Є, —А–µ–ґ–µ, –Ї –њ–∞—А–µ–Ј—Г –ї–Є—Ж–µ–≤–Њ–≥–Њ –љ–µ—А–≤–∞ –Є–ї–Є –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П–Љ –≤ –Ї–Њ—А–Љ–ї–µ–љ–Є–Є –Є –≥–ї–Њ—В–∞–љ–Є–Є. [1,2,7] –£ –і–µ—В–µ–є, —Б—В—А–∞–і–∞—О—Й–Є—Е –Ѓ–Ч–Ю, —З–∞—Б—В–Њ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Ї–Њ—В–Њ—А–∞—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є, –∞–љ–µ–Љ–Є–µ–є –Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є –њ–Њ –њ—А–Є—З–Є–љ–µ –љ–µ–є—В—А–Њ–њ–µ–љ–Є–Є, –Є –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –ї–µ—В–∞–ї—М–љ–Њ–Љ—Г –Є—Б—Е–Њ–і—Г –≤ –њ–µ—А–≤–Њ–Љ –і–µ—Б—П—В–Є–ї–µ—В–Є–Є –ґ–Є–Ј–љ–Є. [3,8]
–Т –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–Њ–≤–ї–µ—З–µ–љ—Л –Љ—Г—В–∞—Ж–Є–Є –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –≥–µ–љ–∞—Е, –≤–ї–Є—П—О—Й–Є–µ –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—О (–љ–∞–њ—А–Є–Љ–µ—А, RANK –Є RANKL) –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ (TCIRG1, CLCN7, OSTM1, CA-II –Є PLEKHM1) –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤. –Я–∞—В–Њ–≥–µ–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –і–∞–љ–љ—Л—Е –≥–µ–љ–∞—Е –њ—А–Њ—П–≤–ї–µ–љ—Л –≤ 70 % —Б–ї—Г—З–∞—П—Е –Ѓ–Ч–Ю.[1вАУ 3,9вАУ12] –Ь—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ TCIRG1 –≤—Б—В—А–µ—З–∞—О—В—Б—П –њ—А–Є–Љ–µ—А–љ–Њ –≤ 50% —Б–ї—Г—З–∞–µ–≤. –Э–µ–і–∞–≤–љ–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ–∞—П –њ–∞—В–Њ–≥–µ–љ–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –≥–µ–љ–∞ SNX1, –Њ–њ–Є—Б–∞–љ–љ–∞—П –і-—А–Њ–Љ –Р–Ї–µ—А–Њ–Љ —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є, –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –∞–љ–Њ–Љ–∞–ї—М–љ–Њ –Љ–µ–ї–Ї–Є—Е –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ї —А–µ–Ј–Њ—А–±—Ж–Є–Є. –Я–Њ–Є—Б–Ї –і—А—Г–≥–Є—Е –±–Њ–ї–µ–Ј–љ–µ—В–≤–Њ—А–љ—Л—Е –≥–µ–љ–Њ–≤ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П.
–Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ —А–∞–і–Є–Ї–∞–ї—М–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –Ѓ–Ч–Ю —П–≤–ї—П–µ—В—Б—П –∞–ї–ї–Њ–≥–µ–љ–љ–∞—П –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–∞—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї (–Ґ–У–°–Ъ).[1,2,15] –£—Б–њ–µ—И–љ–∞—П –Ґ–У–°–Ъ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—О –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –Є, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ, –Ї —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О –Ї–Њ—Б—В–µ–є –Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–∞ –≥–µ–Љ–∞—В–Њ–њ–Њ—Н–Ј–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –Ґ–У–°–Ъ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ —Г –і–µ—В–µ–є —Б –Ѓ–Ч–Ю. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П –≤–Ї–ї—О—З–∞—О—В —В—А—Г–і–љ–Њ—Б—В–Є –≤ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–≥–Њ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї, –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Г—О —Б–Љ–µ—А—В—М –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –≤ —Б–≤—П–Ј–Є —Б –ї–µ–≥–Њ—З–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є, –≤–µ–љ–Њ–Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ—Г—О –±–Њ–ї–µ–Ј–љ—М –њ–µ—З–µ–љ–Є (–Т–Ю–С) –Є —Б–µ–њ—Б–Є—Б.[15вАУ18]
–†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ґ–У–°–Ъ –њ—А–Є –Ѓ–Ч–Ю –і–Њ—Б—В—Г–њ–љ—Л, –љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ—Л, –Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –љ–∞–Є–ї—Г—З—И–µ–≥–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т —Б–µ—А–µ–і–Є–љ–µ 90-—Е –≥–Њ–і–Њ–≤ –њ—А–Њ—И–ї–Њ–≥–Њ —Б—В–Њ–ї–µ—В–Є—П –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ґ–У–°–Ъ –њ—А–Є –Ѓ–Ч–Ю –±—Л–ї –≤–≤–µ–і–µ–љ —А–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Ф–∞–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–Є–ї —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П. –Т —Б—В–∞—В—М–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—И–µ–≥–Њ –Њ–њ—Л—В–∞ –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –і–µ—В–µ–є —Б –Ѓ–Ч–Ю —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—О—Й–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ.
________________________________________________
–Р–±–±—А–µ–≤–Є–∞—В—Г—А—Л: –Р–Ґ–У - –∞–љ—В–Є—В–Є–Љ–Њ—Ж–Є—В–∞—А–љ—Л–є –≥–ї–Њ–±—Г–ї–Є–љ; –Ъ–Ь вАУ –Ї–Њ—Б—В–љ—Л–є –Љ–Њ–Ј–≥; –¶—Б–Р вАУ —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ –Р; –Т–Я–С–Ч вАУ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П; ESID вАУ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–µ –Њ–±—Й–µ—Б—В–≤–Њ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞; –†–Ґ–Я–• вАУ —А–µ–∞–Ї—Ж–Є—П ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї; –Ґ–У–°–Ъ вАУ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Є—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї; IEWPвАУEBMT –†–∞–±–Њ—З–∞—П –≥—А—Г–њ–њ–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ї—А–Њ–≤–Є –Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞; –Ѓ–Ч–Ю вАУ —О–≤–µ–љ–Є–ї—М–љ—Л–є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј; –°–†–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –°–Э–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –Ю–Т вАУ –Њ–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М; –°–Ъ–Я–Ъ вАУ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є; –Т–Ю–С вАУ –≤–µ–љ–Њ–Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М.
[nextpage title="–Ґ–Р–С–Ы–Ш–¶–Р 1. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –і–Њ–љ–Њ—А–Њ–≤"]
–Ґ–Р–С–Ы–Ш–¶–Р 1. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –і–Њ–љ–Њ—А–Њ–≤
| –Ы–µ—З–µ–±–љ—Л–є –њ—А–Њ—В–Њ–Ї–Њ–ї | |||
| –†–µ–ґ–Є–Љ –±–µ–Ј —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ (–≥—А—Г–њ–њ–∞ 1) | –†–µ–ґ–Є–Љ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ (–≥—А—Г–њ–њ–∞ 2) | –†- –≤–µ–ї–Є—З–Є–љ–∞ | |
| –І–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (%) | 12 (31.6) | 26 (68.4) | |
| –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –љ–∞ –Љ–Њ–Љ–µ–љ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –≤ –≥–Њ–і–∞—Е, (–і–Є–∞–њ–∞–Ј–Њ–љ) | 0.45 (0.19-3.14) | 0.92 (0.07-6.71) | 0.3a |
| –Я–Њ–ї | |||
| –Ь—Г–ґ—Б–Ї–Њ–є (%) | 9 (75) | 20 (76.9) | 1b |
| –Ц–µ–љ—Б–Ї–Є–є (%) | 3 (25) | 6 (23.1) | |
| –У–µ–љ—Л | |||
| SNX10 (%) | 2 (16.666) | 5 (19.2) | |
| TCIRG1 (%) | 5 (41.666) | 13 (50) | |
| CLCN7 (%) | - | 1 (3.8) | 0.876b |
| RANK (%) | - | 2 (7.7) | |
| –Ф–∞–љ–љ—Л–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В (%) | 5 (41.66) | 5 (19.2) | |
| –°–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В—М –і–Њ–љ–Њ—А–∞ | |||
| –°–Ф–° (%) | 10 (83.3) | 14 (53.8) | |
| –°–†–Ф (%) | 1 (8.3) | 4 (15.4) | 0.6b |
| –Э–°–†–Ф (%) | 1 (8.3) | 3 (11.5) | |
| –°–Э–Ф (%) | 0 (0) | 3 (11.5) | |
| –Ю–і–Є–љ –ї–Њ–Ї—Г—Б–љ—Л–є –Э–°–Э–Ф (%) | 0 (0) | 2 (7.7) | |
| –¶–Ь–Т-—Б—В–∞—В—Г—Б –і–Њ–љ–Њ—А–∞ | |||
| –Я–Њ–Ј–Є—В–Є–≤–љ—Л–є (%) | 5 (41.6) | 16 (61.5) | |
| –Э–µ–≥–∞—В–Є–≤–љ—Л–є (%) | 2 (16.7) | 2 (7.7) | 0.548b |
| –Э–µ—В –і–∞–љ–љ—Л—Е (%) | 5 (41.6) | 8 (30.8) | |
| –Ш—Б—В–Њ—З–љ–Є–Ї –У–°–Ъ | |||
| –Ъ–Њ—Б—В–љ—Л–є –Љ–Њ–Ј–≥ (%) | 12 (100) | 16 (59.3) | 0.009b |
| –°–Ъ–Я–Ъ (%) | 0 (0) | 11 (40.7) | |
at вАУ –Ј–љ–∞—З–µ–љ–Є–µ –Ї—А–Є—В–µ—А–Є—П. b —В–Њ—З–љ—Л–є –Ї—А–Є—В–µ—А–Є–є –§–Є—И–µ—А–∞; –°–Ф–° вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –і–Њ–љ–Њ—А-—Б–Є–±–ї–Є–љ–≥; –°–†–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –Э–°–†–Ф вАУ –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –°–Э–Ф вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –Э–°–Э–Ф вАУ –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л–є –і–Њ–љ–Њ—А; –¶–Ь–Т вАУ —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б; –°–Ъ–Я–Ъ вАУ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є.
[nextpage title="–Я–Р–¶–Ш–Х–Э–Ґ–Ђ –Ш –Ь–Х–Ґ–Ю–Ф–Ђ"]
–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤
–Т –і–∞–љ–љ–Њ–µ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 38 –і–µ—В–µ–є —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –Ѓ–Ч–Ю (29 –Љ–∞–ї—М—З–Є–Ї–Њ–≤ –Є 9 –і–µ–≤–Њ—З–µ–Ї), –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є 39 –њ—А–Њ—Ж–µ–і—Г—А –У–Ґ–°–Ъ –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ —Ж–µ–љ—В—А–µ ¬Ђ–•–∞–і–∞—Б—Б–∞¬ї –њ—А–Є –Х–≤—А–µ–є—Б–Ї–Њ–Љ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–µ –≤ –њ–µ—А–Є–Њ–і —Б –і–µ–Ї–∞–±—А—П 1983 –≥. –њ–Њ –Њ–Ї—В—П–±—А—М 2014 –≥. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –і–Є–∞–≥–љ–Њ–Ј –Ѓ–Ч–Ю –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –±–Є–Њ–њ—Б–Є–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –∞ —В–∞–Ї–ґ–µ, —Б 2008 –≥, –і–∞–љ–љ—Л–Љ–Є –Љ—Г—В–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ –Ґ–У–°–Ъ –≤—Б–µ –Њ–њ–µ–Ї—Г–љ—Л –њ–Њ–і–њ–Є—Б—Л–≤–∞–ї–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–і–Њ–±—А–µ–љ–Њ –≠–Ї—Б–њ–µ—А—В–љ—Л–Љ —Б–Њ–≤–µ—В–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є ¬Ђ–•–∞–і–∞—Б—Б—Б–∞¬ї. –Ф–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ I.
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї –њ–Њ—Б—В–∞–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 2 –ї–µ—В –ґ–Є–Ј–љ–Є. –Т–Њ–Ј—А–∞—Б—В —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –љ–∞ –Љ–Њ–Љ–µ–љ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–ї –Њ—В 0.07 (1 –Љ–µ—Б—П—Ж) –і–Њ 6.71 –ї–µ—В (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –Њ–Ї–Њ–ї–Њ 8 –Љ–µ—Б—П—Ж–µ–≤). –Т—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М –Ї–∞–Ї –њ–µ—А–Є–Њ–і –≤—А–µ–Љ–µ–љ–Є –Њ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –і–Њ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–≥–Њ –≤–Є–Ј–Є—В–∞. –°—А–µ–і–љ–µ–µ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ–Њ–є —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ 684 –і–љ—П (–Њ—В 123 –і–Њ 10 683 –і–љ–µ–є).
–Ф–∞–љ–љ—Л–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –±—Л–ї–Є –і–Њ—Б—В—Г–њ–љ—Л —Г 28 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (7 –Є–Ј 12 –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –Є 21 –Є–Ј 26 –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ). –£ 18 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Љ—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ TCIRG1 (–Є–Ј –љ–Є—Е –њ—П—В–µ—А–Њ —П–≤–ї—П—О—В—Б—П –љ–Њ—Б–Є—В–µ–ї—П–Љ–Є —Г–љ–Є–Ї–∞–ї—М–љ–Њ–є –І—Г–≤–∞—И—Б–Ї–Њ–є –Љ—Г—В–∞—Ж–Є–Є —Б–∞–є—В–∞ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞, c.807 + 5G>A, —В—А–Њ–µ вАУ –љ–Њ—Б–Є—В–µ–ї—П–Љ–Є —Б–ї–Њ–ґ–љ–Њ–є –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–є –Љ—Г—В–∞—Ж–Є–Є –Є –і–µ—Б—П—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е —Б–µ–Љ–µ–є - –љ–Њ—Б–Є—В–µ–ї—П–Љ–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є –≥–µ–љ–∞ TCIRG1). –°–µ–Љ–µ—А–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Є –Є–Ј –Њ–і–љ–Њ–≥–Њ —А–µ–≥–Є–Њ–љ–∞ –Я–∞–ї–µ—Б—В–Є–љ—Л –Є –Є–Љ–µ–ї–Є –Њ–і–љ—Г –Є —В—Г –ґ–µ –Љ–Є—Б—Б–µ–љ—Б- –Љ—Г—В–∞—Ж–Є—О, c.152 GвЖТA –≤ —Н–Ї–Ј–Њ–љ–µ 3 –≥–µ–љ–∞ SNX10. –Ф–≤–Њ–µ –і–µ—В–µ–є –±—Л–ї–Є –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ—Л –њ–Њ –Љ—Г—В–∞—Ж–Є–Є RANK –Є, —Г –Њ–і–љ–Њ–є –і–µ–≤–Њ—З–Ї–Є –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –≥–µ–љ–∞ CLCN7. –Т—Б–µ –і–µ—В–Є —А–Њ–і–Є–ї–Є—Б—М –Њ—В —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –±—А–∞–Ї–Њ–≤.
–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –і–Њ–љ–Њ—А–Њ–≤
–Ь—Л –њ—А–Є–≤–Њ–і–Є–Љ –Њ–њ–Є—Б–∞–љ–Є–µ –і–≤—Г—Е –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л—Е –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П. –Я–∞—Ж–Є–µ–љ—В—Л –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ (–≥—А—Г–њ–њ–∞ 1, n = 12) –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –і–Њ 1996 –≥–Њ–і–∞ —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –±–µ–Ј —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Я–∞—Ж–Є–µ–љ—В—Л –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ (–≥—А—Г–њ–њ–∞ 2, n = 26), –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —Б–Є–±–ї–Є–љ–≥–Њ–≤ (–±—А–∞—В–∞ –Є–ї–Є —Б–µ—Б—В—А—Л) –Є–ї–Є —З–ї–µ–љ–Њ–≤ —Б–µ–Љ—М–Є. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –і–Њ–љ–Њ—А–Њ–≤ –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ I.
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–Њ–љ–Њ—А–Њ–≤ –≤ –≥—А—Г–њ–њ–µ 1 (n = 12) —П–≤–ї—П–ї–Є—Б—М –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–Љ–Є —З–ї–µ–љ–∞–Љ–Є —Б–µ–Љ—М–Є (10 –Є–Ј 12 - –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–µ —Б–Є–±–ї–Є–љ–≥–Є, 1 - –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є —А–Њ–і–Є—В–µ–ї—М –Є –µ—Й–µ 1 вАУ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –љ–∞ 9/10 —А–Њ–і–Є—В–µ–ї—П). –Т –≥—А—Г–њ–њ–µ 2 (n = 26), —Г 18 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –і–Њ–љ–Њ—А–Њ–≤ (–°–†–Ф) (14 –Є–Ј 18 –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —Б–Є–±–ї–Є–љ–≥–Њ–≤ –Є 4 –Є–Ј 18 –Њ—В –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ —А–Њ–і–Є—В–µ–ї—П). –£ —В—А–Њ–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Њ—В —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞ (–°–Э–Ф), —Г –і–≤–Њ–Є—Е вАУ –Њ—В –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞ (–Њ–і–Є–љ –ї–Њ–Ї—Г—Б–љ—Л–є –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–є –і–Њ–љ–Њ—А) –Є, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, —В—А–Њ–µ –і–µ—В–µ–є –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –і–Њ–љ–Њ—А–Њ–≤ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ CD34+ T-–Ї–ї–µ—В–Њ—З–љ–Њ–є –і–µ–њ–ї–µ—Ж–Є–Є. –Ш–Ј —Н—В–Є—Е —В—А–Њ–Є—Е –Њ–і–Є–љ —А–µ–±–µ–љ–Њ–Ї –њ—А–Њ—Е–Њ–і–Є–ї –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В –Љ–∞—В–µ—А–Є, —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Ї–Њ—В–Њ—А–Њ–є —П–≤–Є–ї–Њ—Б—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –∞ –Ј–∞—В–µ–Љ –±—Л–ї–∞ —Г—Б–њ–µ—И–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–∞ –њ–Њ–≤—В–Њ—А–љ–∞—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –Њ—В —В–Њ–≥–Њ –ґ–µ –і–Њ–љ–Њ—А–∞ [19]; –і—А—Г–≥–Њ–є —А–µ–±–µ–љ–Њ–Ї, –і–µ–≤–Њ—З–Ї–∞ 6 –ї–µ—В, –њ–µ—А–µ–љ–µ—Б–ї–∞ –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —Б–≤–Њ–µ–є –Љ–∞—В–µ—А–Є, –Ї –љ–µ—Б—З–∞—Б—В—М—О, —Б –ї–µ—В–∞–ї—М–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ –њ–Њ –њ—А–Є—З–Є–љ–µ –Њ—В—В–Њ—А–ґ–µ–љ–Є—П –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞; –∞ —В—А–µ—В–Є–є –њ–∞—Ж–Є–µ–љ—В —Г—Б–њ–µ—И–љ–Њ –њ–µ—А–µ–љ–µ—Б —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —А–Њ–і–љ–Њ–є —В–µ—В–Є.
–Ф–Њ–љ–Њ—А–∞–Љ —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є (–°–Ъ–Я–Ъ) –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –њ–Њ–і–Ї–Њ–ґ–љ–∞—П –Є–љ—К–µ–Ї—Ж–Є—П –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –Ї–Њ–ї–Њ–љ–Є–µ—Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ (5 –Љ–≥/–Ї–≥ –і–≤–∞–ґ–і—Л –≤ –і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є), —Б–±–Њ—А –Љ–Њ–±–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –°–Ъ–Я–Ъ –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –љ–∞ 5-—Л–є –Є 6-–Њ–є –і–µ–љ—М –Ї—Г—А—Б–∞. –Э–µ–њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–µ –°–Ъ–Я–Ъ –Є –Ъ–Ь —Б–ї—Г–ґ–Є–ї–Є –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ 11-–Њ–є –Є 28-–Њ–є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –њ—А–Є —Н—В–Њ–Љ –≤ –≥—А—Г–њ–њ–µ 1 –Ъ–Ь –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—В–Њ—З–љ–Є–Ї–∞ —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ 2. –Ю–±–µ –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б—Е–Њ–ґ–Є–Љ–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Љ–Њ–Љ–µ–љ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є, —А–Њ–і—Б—В–≤–∞ –Є –њ–Њ–ї–∞ –і–Њ–љ–Њ—А–∞ –Є –њ–∞—Ж–Є–µ–љ—В–∞, –≥—А—Г–њ–њ –Ї—А–Њ–≤–Є –Є –¶–Ь–Т-—Б—В–∞—В—Г—Б–∞ –і–Њ–љ–Њ—А–∞ –Є —А–µ—Ж–Є–њ–Є–µ–љ—В–∞, –∞ —В–∞–Ї–ґ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —П–і–µ—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–µ.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ —А–µ–∞–Ї—Ж–Є–Є ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (n = 24) –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г —А–µ–∞–Ї—Ж–Є–Є ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї (–†–Ґ–Я–•) –њ—Г—В–µ–Љ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞—А–Є–љ–∞ –Р (–¶—Б –Р) –њ–Њ 3 –Љ–≥/–Ї–≥ –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Б 1 –і–љ—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є. –°–µ–Љ–µ—А–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ—Е–Њ–і–Є–ї–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –¶—Б –Р –Є –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В –Љ–Њ—Д–µ—В–Є–ї. –Ш–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –њ–Њ–і–≥–Њ—В–Њ–≤–Є—В–µ–ї—М–љ—Л–є —А–µ–ґ–Є–Љ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, 22 –њ–Њ–ї—Г—З–∞–ї–Є –Ї—А–Њ–ї–Є—З–Є–є –∞–љ—В–Є—В–Є–Љ–Њ—Ж–Є—В–∞—А–љ—Л–є –≥–ї–Њ–±—Г–ї–Є–љ (–Р–Ґ–У [40 –Љ–≥/–Ї–≥; —Д–∞—А–Љ. –Ї–Њ–Љ–њ–∞–љ–Є–Є –§—А–µ–Ј–µ–љ–Є—Г—Б, –С–∞–і-–•–Њ–Љ–±—Г—А–≥, –У–µ—А–Љ–∞–љ–Є—П] –Є–ї–Є —В–Є–Љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ –≤ —Б—Г–Љ–Љ–∞—А–љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 10 –Љ–≥/–Ї–≥). –Т –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ –њ—А–Є–Љ–µ–љ—П–ї—Б—П –њ—А–µ–њ–∞—А–∞—В –Ъ—Н–Љ–њ–∞—Б 1H, –∞ –≤ –і—А—Г–≥–Є—Е —В—А–µ—Е —Б–ї—Г—З–∞—П—Е –њ–∞—Ж–Є–µ–љ—В—Л –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є —Б–µ—А–Њ—В–µ—А–∞–њ–Є—О. –†–µ–ґ–Є–Љ—Л –±–µ–Ј —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –≤ 5 —Б–ї—Г—З–∞—П—Е –≤–Ї–ї—О—З–∞–ї–Є –Ї—Н–Љ–њ–∞—Б 1G –Є –≤ 2 —Б–ї—Г—З–∞—П—Е - –Р–Ґ–У (—В–∞–±–ї–Є—Ж–∞ II).–°–µ—А–Њ—В–µ—А–∞–њ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б —З–µ—В–≤–µ—А—В–Њ–≥–Њ –і–љ—П –њ–Њ –њ–µ—А–≤—Л–є –≤ –Ї–∞—З–µ—Б—В–≤–µ —З–∞—Б—В–Є —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П.
–Я–∞—Ж–Є–µ–љ—В—Л, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ—А–Њ—П–≤–ї—П–ї–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –†–Ґ–Я–•, –њ–Њ–ї—Г—З–∞–ї–Є –¶—Б–Р –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, 3 –Љ–µ—Б—П—Ж–µ–≤, –∞ –Ј–∞—В–µ–Љ –Ї—Г—А—Б –њ—А–µ–Ї—А–∞—Й–∞–ї—Б—П. –Э–∞–ї–Є—З–Є–µ –Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –†–Ґ–Я–• (–Њ–†–Ґ–Я–• –Є —Е–†–Ґ–Я–•) –Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤.[20] –Я—А–Є –њ–µ—А–≤–Њ–Љ –ґ–µ –њ–Њ—П–≤–ї–µ–љ–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –†–Ґ–Я–•, –њ–∞—Ж–Є–µ–љ—В–∞–Љ –љ–µ–Ј–∞–Љ–µ–і–ї–Є—В–µ–ї—М–љ–Њ –≤–≤–Њ–і–Є–ї—Б—П –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ (2 –Љ–≥/–Ї–≥) –Є –¶—Б–Р.
–Я–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П —В–µ—А–∞–њ–Є—П –Є –∞–љ–∞–ї–Є–Ј –љ–∞ —Е–Є–Љ–µ—А–Є–Ј–Љ
–Т –њ—А–Њ—Ж–µ—Б—Б–µ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є —В—А–Є–Љ–µ—В–Њ–њ—А–Є–Љ/ - —Б—Г–ї—М—Д–∞–Љ–µ—В–Њ–Ї—Б–∞–Ј–Њ–ї, –∞—Ж–Є–Ї–ї–Њ–≤–Є—А –Є –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї. –Я–∞—Ж–Є–µ–љ—В—Л –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–∞–ї–∞—В–∞—Е, –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–љ–Њ–є –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Ј–∞–і–µ—А–ґ–Є–≤–∞—О—Й–µ–Љ —З–∞—Б—В–Є—Ж—Л HEPA - —Д–Є–ї—М—В—А–Њ–Љ –Є –њ–Њ–ї—Г—З–∞–ї–Є —А–µ–≥—Г–ї—П—А–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ. –Ф—А—Г–≥–Є–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –Љ–µ—А—Л, —В–∞–Ї–Є–µ, –Ї–∞–Ї –њ–Њ–ї–љ–Њ–µ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ –Є –њ–µ—А–µ–ї–Є–≤–∞–љ–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ї—А–Њ–≤–Є, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є—Б—М –њ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є. –Р–љ–∞–ї–Є–Ј –љ–∞ –¶–Ь–Т - –∞–љ—В–Є–≥–µ–љ–µ–Љ–Є—О (pp65) –Є–ї–Є –Я–¶–† (–њ–Њ–ї–Є–Љ–µ—А–∞–Ј–љ—Г—О —Ж–µ–њ–љ—Г—О —А–µ–∞–Ї—Ж–Є—О) –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –Ї–∞–ґ–і—Г—О –љ–µ–і–µ–ї—О, –Є –≤ —Б–ї—Г—З–∞–µ —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –љ–∞—З–Є–љ–∞–ї–∞—Б—М –њ—А–µ–≤–µ–љ—В–Є–≤–љ–∞—П –∞–љ—В–Є–≤–Є—А—Г—Б–љ–∞—П —В–µ—А–∞–њ–Є—П.
–Ю—Ж–µ–љ–Ї–∞ —Б—В–µ–њ–µ–љ–Є —Е–Є–Љ–µ—А–Є–Ј–Љ–∞ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ –њ—Г—В–µ–Љ –Њ—В—Б–ї–µ–ґ–Є–≤–∞–љ–Є—П –і–Њ–љ–Њ—А –Є —Е–Њ–Ј—П–Є–љ вАУ —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л—Е –Ф–Э–Ъ-–Љ–∞—А–Ї–µ—А–Њ–≤ —Б –њ–Њ–Љ–Њ—Й—М—О –∞–љ–∞–ї–Є–Ј–∞ –Ї–Њ—А–Њ—В–Ї–Є—Е —В–∞–љ–і–µ–Љ–љ—Л—Е –њ–Њ–≤—В–Њ—А–Њ–≤ (–Љ–µ—В–Њ–і –Њ—Ж–µ–љ–Ї–Є —Б—В–µ–њ–µ–љ–Є —Е–Є–Љ–µ—А–Є–Ј–Љ–∞ –Љ–µ–љ—П–µ—В—Б—П –Є–Ј –≥–Њ–і–∞ –≤ –≥–Њ–і).
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л
–°–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –і–≤—Г—Е –Ї–∞—В–µ–≥–Њ—А–Є–∞–ї—М–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —В–Њ—З–љ–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П –§–Є—И–µ—А–∞. –°—А–∞–≤–љ–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ t-–Ї—А–Є—В–µ—А–Є—П –Є–ї–Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞-–£–Є—В–љ–Є (M-W). –Т—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —А–∞—Б—З–Є—В—Л–≤–∞–ї–∞—Б—М –њ–Њ –Љ–µ—В–Њ–і—Г –Ъ–∞–њ–ї–∞–љ–∞-–Ь–µ–є–µ—А–∞, –∞ —Б—А–∞–≤–љ–µ–љ–Є–µ –Ї—А–Є–≤—Л—Е –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г –њ–Њ–і–≥—А—Г–њ–њ–∞–Љ–Є вАУ —Б –њ–Њ–Љ–Њ—Й—М—О –ї–Њ–≥—А–∞–љ–≥–Њ–≤–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П. –†–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–∞—П –Љ–Њ–і–µ–ї—М –Ъ–Њ–Ї—Б–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –і–ї—П –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –≤–ї–Є—П–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є (–Ю–Т). –Т—Б–µ –њ—А–Є–Љ–µ–љ–µ–љ–љ—Л–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л —П–≤–ї—П–ї–Є—Б—М –і–≤—Г—Е–≤—Л–±–Њ—А–Њ—З–љ—Л–Љ–Є, —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–є —Б—З–Є—В–∞–ї–∞—Б—М –†-–≤–µ–ї–Є—З–Є–љ–∞ –Љ–µ–љ—М—И–∞—П –Є–ї–Є —А–∞–≤–љ–∞—П 0. 05.
–Ґ–Р–С–Ы–Ш–¶–Р II. –Я—А–Њ—В–Њ–Ї–Њ–ї –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П
| –Я—А–Њ—В–Њ–Ї–Њ–ї –≥—А—Г–њ–њ—Л 1 | –І–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ |
|
–С–£/–¶–§/–Ґ–Ґ/–Ї—Н–Љ–њ–∞—Б 1G–С–£/–¶–§ –¶–§/–Ґ–Ю–Ґ –С–£/–Љ–Є—В–Њ–Ї—Б–∞–љ—В—А–Њ–љ/–¶–§/–Ї—Н–Љ–њ–∞—Б 1G –С–£/–¶–§/–Р–Ґ–У –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –†–Ґ–Я–• –¶—Б–Р (%) –¶—Б–Р + –Ь–Ь–§ (%) –Э–µ –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г (%) |
43 2 1 2 9 (75) 0 3 (25) |
| –Я—А–Њ—В–Њ–Ї–Њ–ї –≥—А—Г–њ–њ—Л 2 | –І–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ |
|
–§–Ы–£/–С–£/–Р–Ґ–У–§–Ы–£/–С–£/TT/–Р–Ґ–У –§–Ы–£/–С–£/TT/–Ї—Н–Љ–њ–∞—Б 1H –§–Ы–£/–С–£ –§–Ы–£/–С–£/–Ь–Х–Ы/–Р–Ґ–У –§–Ы–£/–Ґ–†–Х–Ю/TT/–Р–Ґ–У –Ґ–†–Х–Юa/–¶–§/–Р–Ґ–У –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –†–Ґ–Я–• –¶—Б–Р(%) –¶—Б–Р + –Ь–Ь–§ (%) –Э–µ –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г (%) |
94 1 3 1 8 1 15 (58) 7 (27) 4 (15) |
a–†–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–є –≤ —Е–Њ–і–µ –≤—В–Њ—А–Њ–є –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є. –Ъ—Н–Љ–њ–∞—Б 1G = 4 –Љ–≥/–Ї–≥, –Љ–Є—В–Њ–Ї—Б–∞–љ—В—А–Њ–љ = 10 –Љ–≥/–Љ2, –Ї—Н–Љ–њ–∞—Б 1H = 0.8 –Љ–≥/–Ї–≥. –С–£, –±—Г—Б—Г–ї—М—Д–∞–љ (12.8 –Љ–≥/–Ї–≥); –¶–§, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і (200 –Љ–≥/–Љ2); TT, —В–Є–Њ—В–µ–њ–∞ (10 –Љ–≥/–Ї–≥); –¶–§, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і (60 –Љ–≥/–Ї–≥); –Ґ–Ю–Ґ, —В–Њ—В–∞–ї—М–љ–Њ–µ –Њ–±–ї—Г—З–µ–љ–Є–µ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ (1200 —А–∞–і); –Р–Ґ–У, —В–Є–Љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ (10 –Љ–≥/–Ї–≥) –Є–ї–Є –Р–Ґ–У (–§—А–µ–Ј–µ–љ–Є—Г—Б) (40 –Љ–≥/–Ї–≥); –Я–Ґ–Т–•, —А–µ–∞–Ї—Ж–Є—П ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї; –¶—Б–Р, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ A; –Ь–Ь–§, –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В –Љ–Њ—Д–µ—В–Є–ї; –§–Ы–£, —Д–ї—Г–і–∞—А–∞–±–Є–љ (180 –Љ–≥/–Љ2); –Ь–Х–Ы, –Љ–µ–ї—Д–∞–ї–∞–љ (70 –Љ–≥/–Љ2); –Ґ–†–Х–Ю, —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ (12 –≥/–Љ2, –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–ї–∞–і—И–µ 1 –≥–Њ–і–∞; 14 –≥/–Љ2, –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 1 –≥–Њ–і–∞).
[nextpage title="–†–Х–Ч–£–Ы–ђ–Ґ–Р–Ґ–Ђ"]
–Я—А–Є–ґ–Є–≤–ї–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –Њ–†–Ґ–Я–• –Є —Е–†–Ґ–Я–•
–Т –≥—А—Г–њ–њ–µ —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –±–µ–Ј —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ (–≥—А—Г–њ–њ–∞ 1), –Љ–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –і–Њ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (–Р–І–Э –≤—Л—И–µ 0.5 √Ч 109/–ї –≤ —В–µ—З–µ–љ–Є–µ 3-–µ—Е –і–љ–µ–є –њ–Њ–і—А—П–і) —Б–Њ—Б—В–∞–≤–Є–ї–∞ 23 –і–љ—П (–Њ—В 20 –і–Њ 32 –і–љ–µ–є), –∞ –≤ –≥—А—Г–њ–њ–µ —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ (–≥—А—Г–њ–њ–∞ 2) - 19 –і–љ–µ–є (–Њ—В 10 –і–Њ 53), —Е–Њ—В—П —А–∞–Ј–љ–Є—Ж–∞ –љ–µ –і–Њ—Б—В–Є–≥–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є (–†- –≤–µ–ї–Є—З–Є–љ–∞ = 0.199 (MвАУW) (–†–Є—Б. 1). –Ь–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –±–Њ–ї–µ–µ 20 √Ч 109/–ї —Б–Њ—Б—В–∞–≤–Є–ї–∞ 48 –і–љ–µ–є (–Њ—В 25 –і–Њ 75) –≤ –≥—А—Г–њ–њ–µ 1 –Є 33.5 –і–љ–µ–є (–Њ—В 9 –і–Њ 64) –≤ –≥—А—Г–њ–њ–µ 2, —Г—А–Њ–≤–µ–љ—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є P = 0.01 (MвАУW), –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2.
–Ш–Ј –≤—Б–µ–є –≤—Л–±–Њ—А–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В–Њ–ї—М–Ї–Њ —Г 4 —А–∞–Ј–≤–Є–ї–∞—Б—М –†–Ґ–Я–• 2-3 —Б—В–µ–њ–µ–љ–Є, –∞ —Г 2 –Є–Ј –љ–Є—Е —А–µ–∞–Ї—Ж–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–∞ –≤ –ї–Є–Љ–Є—В–Є—А–Њ–≤–∞–љ–љ—Г—О —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –†–Ґ–Я–•.
–У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П –Є –Т–Ю–С –њ–µ—З–µ–љ–Є
–Ф–∞–љ–љ—Л–µ –њ–Њ –њ–Њ—Б—В—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Њ–љ–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О –Ї–∞–ї—М—Ж–Є—П –±—Л–ї–Є –і–Њ—Б—В—Г–њ–љ—Л –і–ї—П 22 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј –≥—А—Г–њ–њ—Л 2. –Ш–Ј –љ–Є—Е —Г 14 (63%) —Г—А–Њ–≤–µ–љ—М —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П –њ—А–µ–≤—Л—И–∞–ї 2.55 –Љ–Љ–Њ–ї—М/–ї (–љ–Њ—А–Љ–∞–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М—Ж–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 2.15вАУ2.55 –Љ–Љ–Њ–ї—М/–ї). –Я–µ—А–≤—Л–є –њ–Њ–і—К–µ–Љ —Г—А–Њ–≤–љ—П –Ї–∞–ї—М—Ж–Є—П –±—Л–ї –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –≤ —Б—А–µ–і–љ–µ–Љ —Б–њ—Г—Б—В—П 19.5 –і–љ–µ–є –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є (–Њ—В 2 –і–Њ 172 –і–љ–µ–є). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–µ–є –њ–Њ–ї—Г—З–∞–ї–Є –ї–µ—З–µ–љ–Є–µ —Б–Њ–≥–ї–∞—Б–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–Љ—Г –њ—А–Њ—В–Њ–Ї–Њ–ї—Г, –≤–Ї–ї—О—З–∞—П –≥–Є–і—А–∞—В–∞—Ж–Є—О, –≤—Л–љ—Г–ґ–і–µ–љ–љ—Л–є –і–Є—Г—А–µ–Ј —Д—Г—А–Њ—Б–µ–Љ–Є–і–Њ–Љ, –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ –Є —Б—В–µ—А–Њ–Є–і—Л. –С–Є—Б—Д–Њ—Д–Њ–љ–∞—В—Л –љ–µ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М. –У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ —Г—Б—В—А–∞–љ–µ–љ–∞ –±–µ–Ј –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Ч–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Т–Ю–С –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 1 (7 –Є–Ј 12 –њ–∞—Ж–Є–µ–љ—В–Њ–≤), —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ 2 (3 –Є–Ј 25 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) (P = 0.009). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Т–Ю–С –≤—Л–ґ–Є–ї–Є. –Ф–µ—Д–Є–±—А–Њ—В–Є–і –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Т–Ю–С –љ–µ –њ—А–Є–Љ–µ–љ—П–ї—Б—П.
–Э–µ–Њ–±—Л—З–љ—Л–Љ —П–≤–Є–ї–Њ—Б—М —В–Њ, —З—В–Њ —В–Њ–ї—М–Ї–Њ —Г –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Є–Ј –≤—Б–µ—Е (–≤ –≥—А—Г–њ–њ–µ 2) —А–∞–Ј–≤–Є–ї–∞—Б—М –ї–µ–≥–Њ—З–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П. –Ф–∞–љ–љ—Л—Е –њ–Њ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Є–Ј –≥—А—Г–њ–њ—Л 1 –љ–µ –њ–Њ—Б—В—Г–њ–∞–ї–Њ.
–†–Є—Б. 1. –Т–µ—А–Њ—П—В–љ–Њ—Б—В–љ–∞—П –Ї—А–Є–≤–∞—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Р–І–Э > 0.5 √Ч 109/–ї –≤ –ї–µ—З–µ–±–љ—Л—Е –≥—А—Г–њ–њ–∞—Е. –Ь–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 23 –і–љ—П –≤ –≥—А—Г–њ–њ–µ 1 –Є 19 –і–љ–µ–є –≤ –≥—А—Г–њ–њ–µ 2, —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –љ–µ –і–Њ—Б—В–Є–≥–љ—Г—В–∞.
–†–Є—Б. 2. –Т–µ—А–Њ—П—В–љ–Њ—Б—В–љ–∞—П –Ї—А–Є–≤–∞—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —З–Є—Б–ї–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ > 20 √Ч 109/–ї –≤ –ї–µ—З–µ–±–љ—Л—Е –≥—А—Г–њ–њ–∞—Е. –Ь–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 48 –і–љ–µ–є –≤ –≥—А—Г–њ–њ–µ 1 –Є 33.5 –і–љ—П –≤ –≥—А—Г–њ–њ–µ 2 , —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –і–Њ—Б—В–Є–≥–љ—Г—В–∞.
–†–Є—Б. 3. –Т–µ—А–Њ—П—В–љ–Њ—Б—В–љ–∞—П –Ї—А–Є–≤–∞—П –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ. –Ш–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Л–ґ–Є–ї–Є 32 (84 %), —Б—А–µ–і–љ—П—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –≤—А–µ–Љ–µ–љ–Є –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 684 –і–љ—П, –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 2 (96%). –Т –≥—А—Г–њ–њ–µ 2 —Г–Љ–µ—А –Њ–і–Є–љ –њ–∞—Ж–Є–µ–љ—В, –≤ –≥—А—Г–њ–њ–µ 1 - –њ—П—В–µ—А–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Т—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–µ–Ј –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Є –Ю–Т
–Ш–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, 32 (84 %) –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –ґ–Є–≤—Л –≤ —В–µ—З–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П 684 –і–љ—П, –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 2 (96 %) (—Б—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П 202 –і–љ—П, 123 - 4 906 –і–љ–µ–є), –∞ –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ 1 —Б–Њ—Б—В–∞–≤–Є–ї–∞ 58 % (—Б—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П 672 –і–љ—П, 291 вАУ 10 683 –і–љ—П). –Ч–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ —В–Њ–ї—М–Ї–Њ –Њ–і–Є–љ –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і –≤ –≥—А—Г–њ–њ–µ 2 (—Г –і–µ–≤–Њ—З–Ї–Є 6-—В–Є –ї–µ—В, –њ—А–Њ—Е–Њ–і–Є–≤—И–µ–є –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О, —А–∞–Ј–≤–Є–ї–Њ—Б—М –њ–µ—А–≤–Є—З–љ–Њ–µ –љ–µ–њ—А–Є–ґ–Є–≤–ї–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞) –Є 5 –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ –≥—А—Г–њ–њ–µ 1 (P = 0.004). –Т –≥—А—Г–њ–њ–µ 1 –і–≤–Њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г–Љ–µ—А–ї–Є –њ–Њ –њ—А–Є—З–Є–љ–µ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –љ–µ–њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –њ—А–Є—З–Є–љ–∞ —Б–Љ–µ—А—В–Є —В—А–µ—Е –і—А—Г–≥–Є—Е –і–µ—В–µ–є вАУ –Т–Ю–С –Є –Є–љ—Д–µ–Ї—Ж–Є–Є. –Р–љ–∞–ї–Є–Ј –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–Њ –Љ–µ—В–Њ–і—Г –Ъ–∞–њ–ї–∞–љ–∞-–Ь–µ–є–µ—А–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–∞ —А–Є—Б. 3.
–°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —А–Є—Б–Ї–Њ–≤ (HR) –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –њ–Њ–і—Б—З–Є—В–∞–љ–Њ —Б –њ–Њ–Љ–Њ—Й—М—О —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–є –Љ–Њ–і–µ–ї–Є –Ъ–Њ–Ї—Б–∞, —Б —Г—З–µ—В–Њ–Љ –≤–ї–Є—П–љ–Є—П –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞ –Љ–Њ–Љ–µ–љ—В —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ъ–Ь –Є –і–Њ–љ–Њ—А—Б–Ї–Њ–є —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є –љ–∞ –Ї–Њ–љ–µ—З–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В –њ—А–Њ—Ж–µ–і—Г—А—Л. –Ю–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 2; –≤ –≥—А—Г–њ–њ–µ 1 —А–Є—Б–Ї –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ, HR = 97. 627 (–і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї 95 % 3.104-3073.440, P = 0.009). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤—Б–µ –≤—Л–ґ–Є–≤—И–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л –≤ –≥—А—Г–њ–њ–µ 1 –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є 100 % –і–Њ–љ–Њ—А—Б–Ї–Є–є —Е–Є–Љ–µ—А–Є–Ј–Љ, –∞ –≤ –≥—А—Г–њ–њ–µ 2 (—Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞), 14 –і–µ—В–µ–є –њ–Њ–Ї–∞–Ј–∞–ї–Є –њ–Њ–ї–љ—Л–є –і–Њ–љ–Њ—А—Б–Ї–Є–є —Е–Є–Љ–µ—А–Є–Ј–Љ, 8 - —Б—В–∞–±–Є–ї—М–љ—Л–є —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–Є–Љ–µ—А–Є–Ј–Љ (42-97 % –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї), –∞ —Г –і–≤–Њ–Є—Е —А–∞–Ј–≤–Є–ї–Њ—Б—М –≤—В–Њ—А–Є—З–љ–Њ–µ –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞ –њ–Њ—Б–ї–µ —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П (–≤ –њ–µ—А–≤–Њ–Љ —Б–ї—Г—З–∞–µ, –Ї–∞–Ї —Г–њ–Њ–Љ–Є–љ–∞–ї–Њ—Б—М —А–∞–љ–µ–µ, –њ–Њ—Б–ї–µ –≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–є –Ґ–У–°–Ъ, –њ–∞—Ж–Є–µ–љ—В —Г—Б–њ–µ—И–љ–Њ –њ–µ—А–µ–љ–µ—Б –≤—В–Њ—А–Є—З–љ—Г—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В —В–Њ–≥–Њ –ґ–µ –і–Њ–љ–Њ—А–∞, –∞ –≤–Њ –≤—В–Њ—А–Њ–Љ —Б–ї—Г—З–∞–µ —Б–µ–Љ—М—П –Њ—В–Ї–∞–Ј–∞–ї–∞—Б—М –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –ї–µ—З–µ–љ–Є–µ). –Ф–∞–љ–љ—Л–µ —Е–Є–Љ–µ—А–Є–Ј–Љ–∞ –њ–Њ –і–≤—Г–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Є –љ–µ–і–Њ—Б—В—Г–њ–љ—Л. –°—В–∞–±–Є–ї—М–љ—Л–є —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–Є–Љ–µ—А–Є–Ј–Љ (63-88 % –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї) –љ–∞–±–ї—О–і–∞–ї—Б—П —Г –і–≤—Г—Е –Є–Ј 8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ–∞ –Є —В–Є–Њ—В–µ–њ—Л.
[nextpage title="–Ю–С–°–£–Ц–Ф–Х–Э–Ш–Х –Ш –С–Ы–Р–У–Ю–Ф–Р–†–Э–Ю–°–Ґ–Ш"]
–Ѓ–≤–µ–љ–Є–ї—М–љ—Л–є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј (–Ѓ–Ч–Ю) вАУ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –љ–µ–Є–Ј–±–µ–ґ–љ–Њ —П–≤–ї—П–µ—В—Б—П —Б–Љ–µ—А—В–µ–ї—М–љ—Л–Љ, –µ—Б–ї–Є –ї–µ—З–µ–љ–Є–µ –љ–µ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤–Њ–≤—А–µ–Љ—П. –Ґ–У–°–Ъ вАУ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є —А–∞–і–Є–Ї–∞–ї—М–љ—Л–є –Љ–µ—В–Њ–і –ї–µ—З–µ–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ґ—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–Њ–Ї–∞–Ј–∞–ї–∞ —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –ї–µ—З–µ–љ–Є–Є –Ѓ–Ч–Ю —Г –Љ—Л—И–µ–є, —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–∞ —Б–Њ—Е—А–∞–љ–µ–љ–Є—О –Ј—А–µ–љ–Є—П –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –≥–µ–Љ–Њ–њ–Њ—Н–Ј–∞, –µ—Б–ї–Є –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –њ–Њ—Б–ї–µ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –±—Г—Б—Г–ї—М—Д–∞–љ–∞.[21,22] –Я–µ—А–≤—Л–µ –њ—А–Њ—Ж–µ–і—Г—А—Л –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ѓ–Ч–Ю —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—А–Њ–≤–µ–і–µ–љ—Л –і-—А–Њ–Љ –С–∞–ї–ї–µ—В–Њ–Љ —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є –≤ 1977 –≥–Њ–і—Г –Є –і-—А–Њ–Љ –Ъ–Њ—З—З–Є–∞ –≤ 1980 –≥. [23,24] –Х–і–Є–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–ї–Њ [15], –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –њ—А–∞–Ї—В–Є–Ї–∞ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В—А–∞–љ –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е —Ж–µ–љ—В—А–Њ–≤. –†–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –±—Л–ї –≤–≤–µ–і–µ–љ –≤ –њ—А–∞–Ї—В–Є–Ї—Г –≤ —Б–µ—А–µ–і–Є–љ–µ 90-—Е –≥–Њ–і–Њ–≤ 20 –≤–µ–Ї–∞. –С—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –і–Њ–Ї–ї–∞–і—Л –Њ –њ–µ—А–≤—Л—Е —Б–ї—Г—З–∞—П—Е –Є, –њ–Њ–Ј–і–љ–µ–µ, –±–Њ–ї–µ–µ –Љ–∞—Б—И—В–∞–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Њ–њ–Є—Б—Л–≤–∞–≤—И–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –і–∞–љ–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –≤ –ї–µ—З–µ–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. [25вАУ31] –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –ї–Є—И—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ґ–У–°–Ъ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ѓ–Ч–Ю.
–Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і–Њ–Ї–ї–∞–і–∞—Е –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ї—А–Њ–≤–Є –Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (EBMT) —Б–Њ–і–µ—А–ґ–∞—В—Б—П –і–∞–љ–љ—Л–µ –њ–Њ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±–µ–Ј –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П (–Т–С–Я), —А–∞–≤–љ–Њ–є 73-79 % –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В –°–†–Ф, –∞ –њ—А–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ —А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ, —А–∞–≤–љ–Њ–є 38-43 %. [15,32]
–Э–µ–і–∞–≤–љ–Њ –±—Л–ї–Є —Б–Њ–±—А–∞–љ—Л –і–∞–љ–љ—Л–µ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є —Г 125 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю –њ—А–Є —Г—З–∞—Б—В–Є–Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ (ESID) –Є –†–∞–±–Њ—З–µ–є –≥—А—Г–њ–њ–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є EBMT (IEWPвАУEBMT). –Я—П—В–Є–ї–µ—В–љ—П—П –Т–С–Я –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г 88 % —А–µ—Ж–Є–њ–Є–µ–љ—В–Њ–≤ –њ—А–Є HLA-–Є–і–µ–љ—В–Є—З–љ–Њ–є –Ґ–У–°–Ъ, 80 % - –њ—А–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В HLA-—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ, –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞ –Є 66 % - –њ—А–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В HLA-–≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–≥–Њ –і–Њ–љ–Њ—А–∞.[33] –Т –і—А—Г–≥–Њ–Љ –і–Њ–Ї–ї–∞–і–µ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є 193 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –≥–і–µ –і–Њ–ї—П –≤—Л–ґ–Є–≤—И–Є—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В 62 % –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Њ—В HLA-—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ–≥–Њ —Б–Є–±–ї–Є–љ–≥–∞ –Є 42 % - –њ–Њ—Б–ї–µ –і—А—Г–≥–Є—Е, –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е –≤–Є–і–Њ–≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є. [34] –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –±—Г—Б—Г–ї—М—Д–∞–љ–∞ –Є —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–∞.
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б—В–∞–љ–і–∞—А—В–љ—Л–є –њ—А–Њ—В–Њ–Ї–Њ–ї –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Є –Ґ–У–°–Ъ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї—Б—П —Б –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–±–Њ–ї—М—И–Є—Е –Њ–і–љ–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —А–µ–ґ–Є–Љ–Њ–≤ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О, —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Т 2006 –≥–Њ–і—Г –і-—А –Ґ–Њ–ї–∞—А —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є —Б–Њ–Њ–±—Й–∞–ї–Є –Њ 55 % –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —Б—А–µ–і–Є 11 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є –Ґ–У–°–Ъ –њ–Њ —А–µ–ґ–Є–Љ–∞–Љ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О.[17]
–Т –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –Њ–і–љ–∞ –≥—А—Г–њ–њ–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –Ґ–У–°–Ъ –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ —Ж–µ–љ—В—А–µ ¬Ђ–•–∞–і–∞—Б—Б–∞¬ї –≤ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–µ 30, –Є —Б—А–∞–≤–љ–Є–≤–∞—О—В—Б—П —Б—В–∞–љ–і–∞—А—В–љ—Л–µ —А–µ–ґ–Є–Љ—Л –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–Њ –Ї–Њ–љ—Ж–∞ 90-—Е –≥–Њ–і–Њ–≤, —Б –љ–Њ–≤—Л–Љ —А–µ–ґ–Є–Љ–Њ–Љ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –±—Л–ї –≤–≤–µ–і–µ–љ –≤ –њ—А–∞–Ї—В–Є–Ї—Г —Б 1998 –≥–Њ–і–∞. –Э–Є–ґ–µ –њ—А–Є–≤–Њ–і—П—В—Б—П –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Ж–µ–љ–љ—Л–µ –љ–∞–±–ї—О–і–µ–љ–Є—П, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Т–Ю–С —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ґ–У–°–Ъ. –£ –і–µ—В–µ–є —Б –Ѓ–Ч–Ю, –њ–µ—А–µ–љ–µ—Б—И–Є—Е —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –і–∞–љ–љ–Њ–≥–Њ –Њ–њ–∞—Б–љ–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –Т–Ю–С –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –њ—Г—В–µ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–µ—Д–Є–±—А–Њ—В–Є–і–∞.[16] –Ю–±–љ–∞—А—Г–ґ–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є—В–Є—П –Т–Ю–С —Г –і–µ—В–µ–є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞.
–У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П вАУ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–µ –њ–Њ—Б—В—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Њ–љ–љ–Њ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю. [1,2,8,15,35,36] –Я–Њ –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –≤–∞—А—М–Є—А—Г–µ—В—Б—П –Њ—В 16 –і–Њ 40 % [15,36,37] –Т —Е–Њ–і–µ –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–Њ—Б—В—Г–њ–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П —А–∞–Ј–≤–Є–ї–∞—Б—М —Г 78 % –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 19.5 –і–љ–µ–є –њ–Њ—Б–ї–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є (–Њ—В 2 –і–Њ 172 –і–љ–µ–є). –°—В–Њ–ї—М –≤—Л—Б–Њ–Ї–∞—П –њ—А–Њ—П–≤–ї–µ–љ–љ–Њ—Б—В—М –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П —В–µ–Љ, —З—В–Њ –≤–µ—А—Е–љ–Є–є –њ—А–µ–і–µ–ї –љ–Њ—А–Љ—Л –Ї–∞–ї—М—Ж–Є—П, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–є –≤ –љ–∞—И–µ–Љ —Ж–µ–љ—В—А–µ (2.55 –Љ–Љ–Њ–ї—М/–ї; 10.3 –Љ–≥/–і–ї) –љ–Є–ґ–µ, —З–µ–Љ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л–µ –≥—А–∞–љ–Є—Ж—Л (10.8вАУ11.5 –Љ–≥/–і–ї).[15,36,37] –Ф-—А –Ь–∞—А—В–Є–љ–µ–Ј —Б –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є [36] –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–µ–є –Є —В–Є–њ–Њ–Љ –і–Њ–љ–Њ—А—Б–Ї–Њ–≥–Њ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –њ–µ—А–µ—Б–∞–ґ–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В—М—О –њ–Њ HLA –Є–ї–Є —З–Є—Б–ї–Њ–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–є. –Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є –±—Л–ї —Б—В–∞—А—И–Є–є –≤–Њ–Ј—А–∞—Б—В —А–µ–±–µ–љ–Ї–∞ –љ–∞ –Љ–Њ–Љ–µ–љ—В –Ґ–У–°–Ъ. –Э–µ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Ґ–У–°–Ъ –Є –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–µ–є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤—Б–µ –љ–∞—И–Є –њ–∞—Ж–Є–µ–љ—В—Л, –Ї—А–Њ–Љ–µ –і–≤–Њ–Є—Е –Є–Ј –≥—А—Г–њ–њ—Л 2, –њ–µ—А–µ–љ–µ—Б–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 2-—Е –ї–µ—В. –°—Г—Й–µ—Б—В–≤—Г–µ—В –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –≤–∞—А–Є–∞–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Є–±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ–Є —П–≤–ї—П–µ—В—Б—П –≥–Є–і—А–∞—В–∞—Ж–Є—П –Є –њ–µ—В–ї–µ–≤—Л–µ –і–Є—Г—А–µ—В–Є–Ї–Є. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—А—Л –≤–Ї–ї—О—З–∞—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤, –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞, –±–Є—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤, —Б –њ–µ—А–µ–Љ–µ–љ–љ—Л–Љ —Г—Б–њ–µ—Е–Њ–Љ –ї–µ—З–µ–љ–Є—П. [33,35вАУ37] –Я—А–µ–њ–∞—А–∞—В –і–µ–љ–Њ—Б—Г–Љ–∞–± (–Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ–Њ–µ –∞–љ—В–Є—В–µ–ї–Њ –Ї RANKL), –љ–∞–Є–±–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є —Б–њ–Њ—Б–Њ–± –ї–µ—З–µ–љ–Є—П —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –Є —В—А—Г–і–љ–Њ–Є–Ј–ї–µ—З–Є–Љ–Њ–є –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є, –±—Л—Б—В—А–Њ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М—Ж–Є—П —Г –±–Њ–ї—М–љ—Л—Е .[33,38] –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П –±—Л–ї–∞ —Г—Б–њ–µ—И–љ–Њ —Г—Б—В—А–∞–љ–µ–љ–∞ –±–ї–∞–≥–Њ–і–∞—А—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤—Л–љ—Г–ґ–і–µ–љ–љ–Њ–≥–Њ –і–Є—Г—А–µ–Ј–∞, –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞ –Є —Б—В–µ—А–Њ–Є–і–Њ–≤.
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —А–∞–Ј–ї–Є—З–Є–є –≤ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —А–µ–ґ–Є–Љ–∞ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, –Њ–і–љ–∞–Ї–Њ –≤—А–µ–Љ—П –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —З–Є—Б–ї–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, —А–∞–≤–љ–Њ–≥–Њ 20,000 –±—Л–ї–Њ –Љ–µ–љ—М—И–µ –≤ –≥—А—Г–њ–њ–µ —А–µ–ґ–Є–Љ–∞ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є, –±–µ–Ј –Ї–∞–Ї–Њ–≥–Њ-–ї–Є–±–Њ —Б–љ–Є–ґ–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ю–Т –Є–ї–Є –Т–С–Я. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, 8 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ —А–µ–ґ–Є–Љ—Г –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–є —Б—В–∞–±–Є–ї—М–љ—Л–є —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–Є–Љ–µ—А–Є–Ј–Љ –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ф–∞–љ–љ—Л–є —Д–µ–љ–Њ–Љ–µ–љ –±—Л–ї –Њ–њ–Є—Б–∞–љ –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Њ—В—З–µ—В–∞—Е –њ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—О –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ–Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є,[39] –Є –љ—Г–ґ–і–∞–µ—В—Б—П –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Є–Ј—Г—З–µ–љ–Є–Є.
–Ч–љ–∞—З–µ–љ–Є–µ –Р–Ґ–У –≤ —А–µ–ґ–Є–Љ–∞—Е –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ –і–Њ –Ї–Њ–љ—Ж–∞. –Р–Ґ–У –≤—Л–Ј—Л–≤–∞–µ—В –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є—О —Г —А–µ—Ж–Є–њ–Є–µ–љ—В–∞, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П —Г–ї—Г—З—И–µ–љ–Є—О –њ—А–Є–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –Є –Њ—Б—В–∞–µ—В—Б—П –≤ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є, –≤—Л–Ј—Л–≤–∞—П —З–∞—Б—В–Є—З–љ—Г—О –і–µ–њ–ї–µ—Ж–Є—О in vivo –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ґ-–Ї–ї–µ—В–Њ–Ї, –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О –Ј–∞—Й–Є—В—Г –Њ—В –†–Ґ–Я–•.[40вАУ42] –Т —Е–Њ–і–µ –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 22 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О —Б —А–µ–ґ–Є–Љ–Њ–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞, –њ–Њ–ї—Г—З–∞–ї–Є —Б–µ—А–Њ—В–µ—А–∞–њ–Є—О –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –Ї –њ—А–Њ—Ж–µ–і—Г—А–µ, –њ—А–Є —Н—В–Њ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –њ–Њ—Б—В—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М.
–Ь—Л –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–Є–Ј–Ї—Г—О —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –†–Ґ–Я–• —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т–Њ–Ј–Љ–Њ–ґ–љ–∞—П –њ—А–Є—З–Є–љ–∞ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –Љ–љ–Њ–≥–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–Њ—Е–Њ–і–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—О –Њ—В –њ–Њ–ї–љ–Њ—Б—В—М—О –°–†–Ф, –∞ —В–∞–Ї–ґ–µ –±—Л–ї–Є –њ—А–Є–љ—П—В—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—А—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –†–Ґ–Я–•.
–Ю–Т –≤—Б–µ–є –Ї–Њ–≥–Њ—А—В—Л –Є–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 84 %, –њ—А–Є—З–µ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М (96 %) –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞. –Я–Њ–≤—Л—И–µ–љ–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П —Б–љ–Є–ґ–µ–љ–љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О, –∞ —В–∞–Ї–ґ–µ —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В, —З—В–Њ –њ—А–Є–≤–µ–ї–Њ –Ї —Г–ї—Г—З—И–µ–љ–Є—О —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –Є —Б–љ–Є–ґ–µ–љ–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є.
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –µ–і–Є–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ ESID –Є IEWPвАУEBMT, –њ—А–Є–Ј—Л–≤–∞—О—В –Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О —А–µ–ґ–Є–Љ–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ґ–У–°–Ъ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ѓ–Ч–Ю –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –±—Г—Б—Г–ї—М—Д–∞–љ–∞. [33,43] –Ф–∞–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Г–ї—Г—З—И–µ–љ–Є—О –Є—Б—Е–Њ–і–Њ–≤ –Ґ–У–°–Ъ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ѓ–Ч–Ю, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є HLA-–≥–∞–њ–ї–Њ–Є–і–µ–љ—В–Є—З–љ–Њ–є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є.[33]
–Ф–ї—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (18/26) —А–µ–ґ–Є–Љ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Д–ї—Г–і–Њ—А–∞–±–Є–љ–∞ –Є –±—Г—Б—Г–ї—М—Д–∞–љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –±–µ–Ј –Є–Ј–Љ–µ—А–µ–љ–Є—П —Ж–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ–µ–є (—Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞—З–∞–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –ї–Є—И—М –љ–µ–і–∞–≤–љ–Њ), –љ–Њ —Б 2011 –≥–Њ–і–∞ —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Д–ї—Г–і–∞—А–∞–±–Є–љ–Њ–Љ –Є —В–Є–Њ—В–µ–њ–Њ–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –Ґ–У–°–Ъ –њ—А–Є –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е.[44] –Т –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, 8 –Є–Ј 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ—И–ї–Є –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –і–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —Е–Њ—А–Њ—И—Г—О –њ—А–Є–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, –≤—Л—Б–Њ–Ї—Г—О –Т–С–Я –Є –љ–Є–Ј–Ї—Г—О —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Д–ї—Г–і–∞—А–∞–±–Є–љ–∞ —Б –±—Г—Б—Г–ї—М—Д–∞–љ–Њ–Љ (—Б –Є–Ј–Љ–µ—А–µ–љ–Є–µ–Љ —Ж–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ—П–Љ–µ–є) –Є —В—А–µ–Њ—Б—Г–ї—М—Д–∞–љ–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Б–µ—А–Њ—В–µ—А–∞–њ–Є–Є –Є —А–Њ–ї–Є —В–Є–Њ—В–µ–њ—Л –≤ —А–µ–ґ–Є–Љ–∞—Е –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –і–ї—П –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–С–Ы–Р–У–Ю–Ф–Р–†–Э–Ю–°–Ґ–Ш
–Ь—Л –±–ї–∞–≥–Њ–і–∞—А–Є–Љ –љ–∞—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –Є—Е —Б–µ–Љ—М–Є –Ј–∞ –і–Њ–≤–µ—А–Є–µ –Є –њ–Њ–і–і–µ—А–ґ–Ї—Г, –∞ —В–∞–Ї–ґ–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –Є –∞–і–Љ–Є–љ–Є—Б—В—А–∞—В–Є–≤–љ—Л–є –њ–µ—А—Б–Њ–љ–∞–ї –љ–∞—И–µ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П.
[nextpage title="–Ы–Ш–Ґ–Х–†–Р–Ґ–£–†–Р"]
- Mazzolari E, Forino C, Razza A, Porta F, Villa A, Notarangelo A single-center experience in 20 patients with infantile malignant osteopetrosis. Am J Hematol 2009;84:473вАУ479.
- Stark Z, Savarirayan Osteopetrosis. Orphanet J Rare Dis 2009;4:5вАУ17.
- Tolar J, Teitelbaum SL, Orchard Osteopetrosis. N Engl J Med 2004;351:2839вАУ2849.
- Souraty N, Noun P, Djambas-Khayat C, Chouery E, Pangrazio A, Villa A, Lefranc G, Frattini A, M√©garban√© Molecular study of six families originating from the Middle-East and presenting with autosomal recessive osteopetrosis. Eur J Med Genet 2007;50:188вАУ199.
- Bliznetz EA, Tverskaya SM, Zinchenko RA, Abrukova AV, Savaskina EN, Nikulin MV, Kirillov AG, Ginter EK, Polyakov AV. Genetic analysis of autosomal recessive osteopetrosis in Chuvashiya: The unique splice site mutation in TCIRG1 gene spread by the founder Eur J Hum Genet 2009;17:664вАУ672.
- Unnanuntana A, Rebolledo BJ, Khair MM, DiCarlo EF, Lane Diseases affecting bone quality: Beyond osteoporosis. Clin Orthop Relat Res 2011;469:2194вАУ2206.
- da Silva Santos PS, Esperidi√£o AP, de Freitas Maxillofacial aspects in malignant osteopetrosis. Cleft Palate Craniofac J 2009;46:388вАУ390.
- Wilson CJ, Vellodi Autosomal recessive osteopetrosis: Diagnosis, management, and outcome. Arch Dis Child 2000;83:449вАУ452.
- Frattini A, Orchard PJ, Sobacchi C, Giliani S, Abinun M, Mattsson JP, Keeling DJ, Andersson AK, Wallbrandt P, Zecca L, Notarangelo LD, Vezzoni P, Villa Defects in TCIRG1 subunit of the vacuolar proton pump are responsible for a subset of human autosomal recessive osteopetrosis. Nat Genet 2000;25:343вАУ346.
- Boyce BF, Yao Z, Xing Functions of nuclear factor kappaB in bone. Ann N Y Acad Sci 2010;1192:367вАУ375.
- Pangrazio A, Cassani B, Guerrini MM, Crockett JC, Marrella V, Zammataro L, Strina D, Schulz A, Schlack C, Kornak U, Mellis DJ, Duthie A, Helfrich MH, Durandy A, Moshous D, Vellodi A, Chiesa R, Veys P, Lo Iacono N, Vezzoni P, Fischer A, Villa A, Sobacchi RANK-dependent autosomal recessive osteopetrosis: Characterization of five new cases with novel mutations. J Bone Miner Res 2012;27:342вАУ351.
- Novack Role of NF-ќЇB in the skeleton. Cell Res 2011;21:169вАУ182.
- Villa A, Guerrini MM, Cassani B, Pangrazio A, Sobacchi Infantile malignant, autosomal reces- sive osteopetrosis: The rich and the poor. Calcif Tissue Int 2009;84:1вАУ12.
- Aker M, Rouvinski A, Hashavia S, Ta-Shma A, Shaag A, Zenvirt S, Israel S, Weintraub M, Tarabou- los A, Bar-Shavit Z, Elpeleg An SNX10 mutation causes malignant osteopetrosis of infancy. J Med Genet 2012;49:221вАУ226.
- Driessen GJ, Gerritsen EJ, Fischer A, Fasth A, Hop WC, Veys P, Porta F, Cant A, Steward CG, Vossen JM, Uckan D, Friedrich Long-term outcome of haematopoietic stem cell transplantation in autosomal recessive osteopetrosis: An EBMT report. Bone Marrow Transplant 2003;32:657вАУ663.
- Corbacioglu S, H√ґnig M, Lahr G, St√ґhr S, Berry G, Friedrich W, Schulz A Stem cell transplanta- tion in children with infantile osteopetrosis is associated with a high incidence of VOD, which could be prevented with defibrotide. Bone Marrow Transplant 2006;38:547вАУ553.
- Tolar J, Bonfim C, Grewal S, Orchard Engraftment and survival following hematopoietic stem cell transplantation for osteopetrosis using a reduced intensity conditioning regimen. Bone Marrow Transplant 2006;38:783вАУ787.
- Grigg A, Buchanan M, Whitford Late onset pulmonary arterial hypertension in association with graft-versus-host disease after allogeneic stem-cell transplantation. Am J Hematol 2005;80:38вАУ42.
- Stepensky P, Schulz AS, Lahr G, Simanovsky N, Brooks R, Samuel S, Or R, Weintraub M, Resnick
- Successful second haploidentical SCT in osteopetr Bone Marrow Transplant 2011;46:1021вАУ 1022.
- Glucksberg H, Storb R, Fefer A, Buckner CD, Neiman PE, Clift RA, Lerner KG, Thomas Clin- ical manifestations of graft versus host disease in human recipients of marrow from HLA-matched sibling donors. Transplantation 1974;18: 295вАУ304.
- Askmyr M, Holmberg J, Flores C, Ehinger M, Hjalt T, Richter Low-dose busulphan conditioning and neonatal stem cell transplantation preserves vision and restoreshematopoiesis in severe murine osteopetrosis. Exp Hematol 2009;37:302вАУ308.
- Johansson M, Jansson L, Ehinger M, Fasth A, Karlsson S, Richter Neonatal hematopoietic stem cell transplantation cures oc/oc mice from osteopetrosis. Exp Hematol 2006;34:242вАУ249.
- Ballet JJ, Griscelli C, Coutris C, Milhaud G, Maroteaux Bone marrow transplantation in os- teopetrosis. Lancet 1977;ii:1137.
- Coccia PF, Krivit W, Cervenka J, Clawson C, Kersey JH, Kim TH, Nesbit ME, Ramsay NK, Warkentin PI, Teitelbaum SL, Kahn AJ, Brown Successful bone-marrow transplantation for infantile malignant osteopetrosis. N Engl J Med 1980;302:701вАУ708.
- Valc√°rcel D, Martino R, Sureda A, Canals C, Alt√©s A, Briones J, Sanz MA, Parody R, Constans M, Villela SL, Brunet S, Sierra Conventional versus reduced-intensity conditioning regimen for allogeneic stem cell transplantation in patients with hematological malignancies. Eur J Haematol 2005;74:144вАУ151.
- Khouri IF, Keating M, K√ґrbling M, Przepiorka D, Anderlini P, OвАЩBrien S, Giralt S, Ippoliti C, von Wolff B, Gajewski J, Donato M, Claxton D, Ueno N, Andersson B, Gee A, Cham- plin Transplant-lite: Induction of graft-versus-malignancy using fludarabine-based nonablative chemotherapy andallogeneic blood progenitor-cell transplantation as treatment for lymphoid ma- lignancies. J Clin Oncol 1998;16:2817вАУ2824.
- Kapelushnik J, Or R, Slavin S, Nagler A. A fludarabine-based protocol for bone marrow transplan- tation in FanconiвАЩs Bone Marrow Transplant 1997;20:1109вАУ1110.
- Aker M, Varadi G, Slavin S, Nagler A fludarabine-based protocol for human umbilical cord blood transplantation in children with Fanconi anemia. J Pediatr Hematol Oncol 1999;21:237вАУ239.
- Locatelli F, Zecca M, Pession A, Morreale G, Longoni D, Di Bartolomeo P, Porta F, Fagioli F, Nobili B, Bernardo ME, Messina C. Italian pediatric The outcome of children with Fanconi anemia given hematopoietic stem cell transplantation and the influence of fludarabine in the condi- tioning regimen: A report from the Italian pediatric group. Haematologica 2007;92:1381вАУ1388.
- Yabe H, Inoue H, Matsumoto M, Hamanoue S, Koike T, Ishiguro H, Koike H, Suzuki K, Kato S, Kojima S, Tsuchida M, Mori T, Adachi S, Tsuji K, Koike K, Morimoto A, Sako M, Yabe Allogeneic haematopoietic cell transplantation from alternative donors with a conditioning regimen of low-dose irradiation, fludarabine and cyclophosphamide in Fanconi aneamia. Br J Haematol 2006;134:208вАУ212.
- Stepensky P, Shapira MY, Balashov D, Trakhtman P, Skorobogatova E, Rheingold L, Brooks R, Revel-Vilk S, Weintraub M, Stein J, Maschan A, Or R, Resnick Bone marrow transplan- tation for Fanconi anemia using fludarabine-based conditioning. Biol Blood Marrow Transplant 2011;17:1282вАУ1288.
- Gerritsen EJ, Vossen JM, Fasth A, Friedrich W, Morgan G, Padmos A, Vellodi A, Porras O, OвАЩMeara A, Porta F, Bordigoni P, Cant A, Hermans J, Fischer Bone marrow transplan- tation for autosomal recessive osteopetrosis. A report from the Working Party on Inborn Er- rors of the European Bone Marrow Transplantation Group. J Pediatr 1994;125(6 Pt 1):896вАУ 902.
- Sobacchi C, Schulz A, Coxon FP, Villa A, Helfrich Osteopetrosis: Genetics, treatment and new insights into osteoclast function. Nat Rev Endocrinol 2013;9:522вАУ536.
- Orchard PJ, Fasth AL, Le Rademacher J, He W, Boelens JJ, Horwitz EM, Al-Seraihy A, Ayas M, Bonfim CM, Boulad F, Lund T, Buchbinder DK, Kapoor N, OвАЩBrien TA, Perez MA, Veys PA, Eapen Hematopoietic stem cell transplantation for infantile osteopetrosis. Blood 2015;126:270вАУ 276.
- Rawlinson PS, Green RH, Coggins AM, Boyle IT, Gibson Malignant osteopetrosis: Hypercal- caemia after bone marrow transplantation. Arch Dis Child 1991;66:638вАУ639.
- Martinez C, Polgreen LE, DeFor TE, Kivisto T, Petryk A, Tolar J, Orchard Characterization and management of hypercalcemia following transplantation for osteopetrosis. Bone Marrow Trans- plant 2010;45:939вАУ944.
- Kulpiya A, Mahachoklertwattana P, Pakakasama S, Hongeng S, Poomthavorn Hypercalcemia and altered biochemical bone markers in post-bone marrow transplantation osteopetrosis: A case report and literature review. Pediatr Transplant 2012;16:E140вАУE145.
- Shroff R, Beringer O, Rao K, Hofbauer LC, Schulz Denosumab for post-transplantation hyper- calcemia in osteopetrosis. N Engl J Med 2012;367:1766вАУ1767.
- Lisini D, Zecca M, Giorgiani G, Montagna D, Cristantielli R, Labirio M, Grignani P, Pre- vider√® C, Di Cesare-Merlone A, Amendola G, Bergami E, Mastronuzzi A, Maccario R, Lo- catelli Donor/recipient mixed chimerism does not predict graft failure in children with beta- thalassemia given an allogeneic cord blood transplant from an HLA-identical sibling. Haemato- logica 2008;93:1859вАУ1867.
- Spitzer Engraftment syndrome following hematopoietic stem cell transplantation. Bone Mar- row Transplant 2001;27:893вАУ898.
- Ayuk F, Diyachenko G, Zabelina T, Panse J, Wolschke C, Eiermann T, Binder T, Fehse B, Erttmann R, Kabisch H, Bacher U, Kr√ґger N, Zander Anti-thymocyte globulin overcomes the negative impact of HLA mismatching in transplantation from unrelated donors. Exp Hematol 2008;36:1047вАУ 1054.
- Finke J, Bethge WA, Schmoor C, Ottinger HD, Stelljes M, Zander AR, Volin L, Ruutu T, Heim DA, Schwerdtfeger R, Kolbe K, Mayer J, Maertens JA, Linkesch W, Holler E, Koza V, Bornh√§user M, Einsele H, Kolb HJ, Bertz H, Egger M, Grishina O, Soci√© G; ATG-Fresenius Trial Stan- dard graft-versus- host disease prophylaxis with or without anti-T-cell globulin in haematopoietic cell transplantation from matched unrelated donors: A randomised, open-label, multicentre phase 3 trial. Lancet Oncol 2009;10:855вАУ864.
- Schulz A, Moshous D, Steward CG, Villa OsteopetrosisвАУConsensus guidelines of the ESID and the EBMT working party inborn errors. http://esid.org/Media/Files/OP-Guidelines-2011. Published December 04, 2011, Accessed August 03, 2014.
- Dinur-Schejter Y, Krauss AC, Erlich O, Gorelik N, Yahel A, Porat I, Weintraub M, Stein J, Zaidman I, Stepensky Bone marrow transplantation for non-malignant diseases using treosulfan-based conditioning. Pediatr Blood Cancer 2014; doi: 10.1002/pbc.25267.
–Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є—П
–Ю—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј
–Я—А–Њ—Ж–µ–і—Г—А—Л
–Ґ—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞