–Т —П–љ–≤–∞—А—Б–Ї–Њ–є –Њ–љ–ї–∞–є–љ-–≤–µ—А—Б–Є–Є –ґ—Г—А–љ–∞–ї–∞ "Current Osteoporosis Reports ( (2018) 16:13вАУ25) –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–∞ –Њ–±–Ј–Њ—А–љ–∞—П —Б—В–∞—В—М—П –Є—В–∞–ї—М—П–љ—Б–Ї–Є—Е —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤, –њ–Њ—Б–≤—П—Й–µ–љ–љ–∞—П –≥–µ–љ–µ—В–Є–Ї–µ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞.
–≠–ї–µ–Њ–љ–Њ—А–∞ –Я–∞–ї–∞–≥–∞–љ–Њ1,2, –°–Є—А–Њ –Ь–µ–љ–∞–ї–µ1,3, –Ъ—А–Є—Б—В–Є–љ–∞ –°–Њ–±–∞–Ї–Ї–Є1,3, –Р–љ–љ–∞ –Т–Є–ї–ї–∞1,3
1–Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—В–Є—В—Г—В –≤ –†–Њ—Б—Б–∞–љ–Њ, –Ш—В–∞–ї–Є—П
2–Ю—В–і–µ–ї–µ–љ–Є–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –±–Є–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –Є —В—А–∞–љ—Б–ї—П—Ж–Є–Њ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, –Ь–Є–ї–∞–љ—Б–Ї–Є–є –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л–є —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В, –Ь–Є–ї–∞–љ, –Ш—В–∞–ї–Є—П
3 –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –љ–∞—Г—З–љ–Њ-–Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є–є —Ж–µ–љ—В—А, –Ш–љ—Б—В–Є—В—Г—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є –±–Є–Њ–Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ь–Є–ї–∞–љ, –Ш—В–∞–ї–Є—П
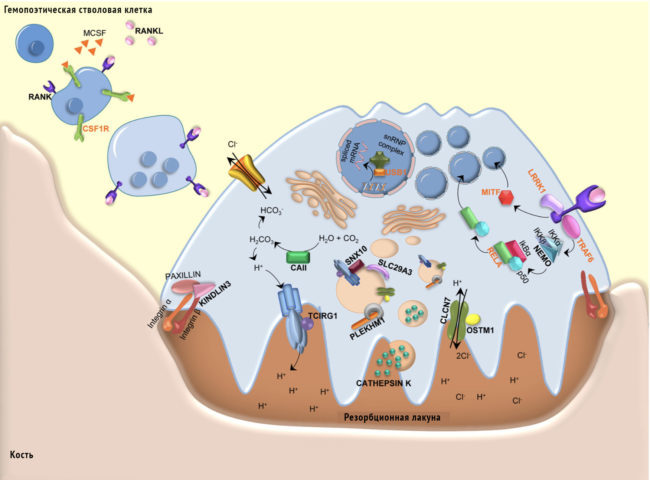 –°—Е–µ–Љ–∞ –Љ–Њ–ї–µ–Ї—Г–ї, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –Є –Є–≥—А–∞—О—Й–Є—Е —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞. –Э–∞–Є–±–Њ–ї–µ–µ –Є–Ј–≤–µ—Б—В–љ—Л–µ –≥–µ–љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤—Л–і–µ–ї–µ–љ—Л –ґ–Є—А–љ—Л–Љ —И—А–Є—Д—В–Њ–Љ —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞. –Э–µ–і–∞–≤–љ–Њ –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –≥–µ–љ—Л –±–Њ–ї–µ–Ј–љ–Є, —Г–њ–Њ–Љ—П–љ—Г—В—Л–µ –≤ —Н—В–Њ–Љ –Њ–±–Ј–Њ—А–µ, –≤—Л–і–µ–ї–µ–љ—Л –ґ–Є—А–љ—Л–Љ —И—А–Є—Д—В–Њ–Љ –Њ—А–∞–љ–ґ–µ–≤–Њ–≥–Њ —Ж–≤–µ—В–∞.
–¶–µ–ї—М –Њ–±–Ј–Њ—А–∞:
–°—Е–µ–Љ–∞ –Љ–Њ–ї–µ–Ї—Г–ї, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –Є –Є–≥—А–∞—О—Й–Є—Е —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞. –Э–∞–Є–±–Њ–ї–µ–µ –Є–Ј–≤–µ—Б—В–љ—Л–µ –≥–µ–љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤—Л–і–µ–ї–µ–љ—Л –ґ–Є—А–љ—Л–Љ —И—А–Є—Д—В–Њ–Љ —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞. –Э–µ–і–∞–≤–љ–Њ –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –≥–µ–љ—Л –±–Њ–ї–µ–Ј–љ–Є, —Г–њ–Њ–Љ—П–љ—Г—В—Л–µ –≤ —Н—В–Њ–Љ –Њ–±–Ј–Њ—А–µ, –≤—Л–і–µ–ї–µ–љ—Л –ґ–Є—А–љ—Л–Љ —И—А–Є—Д—В–Њ–Љ –Њ—А–∞–љ–ґ–µ–≤–Њ–≥–Њ —Ж–≤–µ—В–∞.
–¶–µ–ї—М –Њ–±–Ј–Њ—А–∞:
–Ґ–µ—А–Љ–Є–љ ¬Ђ–Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј¬ї –Њ–±—К–µ–і–Є–љ—П–µ—В –≤ —Б–µ–±–µ –≥—А—Г–њ–њ—Г —А–µ–і–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–Ї–µ–ї–µ—В–∞, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е—Б—П –Њ–і–љ–Є–Љ –Њ–±—Й–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ вАУ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –µ–µ —А–µ–Ј–Њ—А–±—Ж–Є–Є. –Ю—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј вАУ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Є –≤ –µ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–Є –Є –ї–µ—З–µ–љ–Є–Є –љ–µ–Љ–∞–ї–Њ–≤–∞–ґ–љ—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В —В–Њ—З–љ–∞—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П. –Т —Н—В–Њ–є —Б—В–∞—В—М–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –љ–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ –Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞.
–Э–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ:
–Э–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –љ–Њ–≤—Л—Е –Љ—Г—В–∞—Ж–Є—П—Е –Є–Ј–≤–µ—Б—В–љ—Л—Е –≥–µ–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –і–µ—Д–µ–Ї—В–∞—Е¬† –љ–Њ–≤—Л—Е –≥–µ–љ–Њ–≤, —А–∞—Б—И–Є—А—П—О—В –љ–∞—И–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ —Б–њ–µ–Ї—В—А–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј—Г.
–Ъ—А–∞—В–Ї–∞—П —Б–њ—А–∞–≤–Ї–∞:
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –њ–Њ—Б—В–Њ—П–љ–љ–Њ —А–∞—Б—И–Є—А—П–µ—В—Б—П, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ. –Э–µ–Ї–Њ—В–Њ—А—Л–µ —Б–ї–Њ–ґ–љ—Л–µ —Д–µ–љ–Њ—В–Є–њ—Л, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є, –њ–Њ–ї—Г—З–Є–ї–Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Г—О –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О, –≤–Ї–ї—О—З–∞—П —В–∞–Ї–ґ–µ –љ–Њ–≤—Л–µ –≥–µ–љ—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±—Л–ї–Є —А–∞—Б–њ–Њ–Ј–љ–∞–љ—Л –љ–Њ–≤—Л–µ —В–Є–њ—Л –Љ—Г—В–∞—Ж–Є–є, –Ї–Њ—В–Њ—А—Л–µ, –њ–Њ –њ—А–Є—З–Є–љ–µ —Б–≤–Њ–µ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П –Є–ї–Є —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є—П –≤ –≥–µ–љ–Њ–Љ–µ, –±—Л–ї–Њ —В—А—Г–і–љ–Њ –Њ–±–љ–∞—А—Г–ґ–Є—В—М. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –і–ї—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ–∞—В—В–µ—А–љ–Њ–≤ –Љ—Г—В–∞—Ж–Є–Є-–њ—А–Њ–≤–Њ–Ї–∞—В–Њ—А—Л –≤—Б–µ –µ—Й–µ –Њ—Б—В–∞—О—В—Б—П –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є, –∞ –Ј–љ–∞—З–Є—В –Є–Љ–µ–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –∞–Ї—В–Є–≤–љ–Њ–Љ –Є–Ј—Г—З–µ–љ–Є–Є –≥–µ–љ–µ—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞.
–Т–≤–µ–і–µ–љ–Є–µ
–Ґ–µ—А–Љ–Є–љ ¬Ђ–Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј¬ї –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П –≥—А—Г–њ–њ—Г —А–µ–і–Ї–Є—Е –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–Ї–µ–ї–µ—В–∞, –Ї–Њ—В–Њ—А—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –Ј–∞–Љ–µ—В–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –µ–µ —А–µ–Ј–Њ—А–±—Ж–Є–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–∞–Љ–Є вАУ –Ї–ї–µ—В–Ї–∞–Љ–Є, —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–Љ–Є –і–ї—П —Н—В–Њ–є —Д—Г–љ–Ї—Ж–Є–Є. –Ю—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј—Г –њ—А–Є—Б–≤–∞–Є–≤–∞–µ—В—Б—П –Њ–і–љ–∞ –Є–Ј 3-–µ—Е —Д–Њ—А–Љ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —В–Є–њ–∞ –љ–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –∞—Г—В–Њ—Б–Њ–Љ–љ–Њ-—А–µ—Ж–µ—Б—Б–Є–≤–љ–Њ–≥–Њ (–Р–†–Ю), –∞—Г—В–Њ—Б–Њ–Љ–љ–Њ-–і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ–≥–Њ (–Р–Ф–Ю) –Є –•-—Б—Ж–µ–њ–ї–µ–љ–љ–Њ–≥–Њ.
–Ч–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М A–†–Ю —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1 –љ–∞ 250¬†000 –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е, –љ–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е (–љ–∞–њ—А–Є–Љ–µ—А, –≤ –Ъ–Њ—Б—В–∞-–†–Є–Ї–µ, –°—А–µ–і–љ–µ–Љ –Т–Њ—Б—В–Њ–Ї–µ, –І—Г–≤–∞—И—Б–Ї–Њ–є —А–µ—Б–њ—Г–±–ї–Є–Ї–µ –†–§ –Є –У—А–∞—Д—Б—В–≤–µ –Т–µ—Б—В–µ—А–±–Њ—В—В–Њ–љ, –®–≤–µ—Ж–Є—П) —Н—В–∞ —Ж–Є—Д—А–∞ –≤—Л—И–µ –Є–Ј-–Ј–∞ —В.–љ. ¬Ђ—Н—Д—Д–µ–Ї—В–∞ –Њ—Б–љ–Њ–≤–∞—В–µ–ї—П¬ї, –≥–µ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Є–Ј–Њ–ї—П—Ж–Є–Є –Є–ї–Є –±–ї–Є–Ј–Ї–Њ–≥–Њ —А–Њ–і—Б—В–≤–∞ —А–Њ–і–Є—В–µ–ї–µ–є.
–Э–∞—А—П–і—Г —Б —В–µ—А–Љ–Є–љ–Њ–Љ ¬Ђ–∞—Г—В–Њ—Б–Њ–Љ–љ–Њ-—А–µ—Ж–µ—Б—Б–Є–≤–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј¬ї —В–∞–Ї–ґ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —В–µ—А–Љ–Є–љ ¬Ђ–Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є —О–≤–µ–љ–Є–ї—М–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј¬ї (–Ѓ–Ч–Ю), —В.–Ї. –і–∞–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –≤—Б–Ї–Њ—А–µ –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П, –Є –±–µ–Ј –ї–µ—З–µ–љ–Є—П –Ј–∞—З–∞—Б—В—Г—О –њ—А–Є–≤–Њ–і–Є—В –Ї –ї–µ—В–∞–ї—М–љ–Њ–Љ—Г –Є—Б—Е–Њ–і—Г.
–Ч–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Р–Ф–Ю —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1 –љ–∞ 20¬†000 –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е. –Х–≥–Њ —В–∞–Ї–ґ–µ –љ–∞–Ј—Л–≤–∞—О—В –њ–Њ–Ј–і–љ–µ–є —Д–Њ—А–Љ–Њ–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –±–Њ–ї–µ–Ј–љ—М –≤–њ–µ—А–≤—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ —О–љ–Њ—Б—В–Є –Є–ї–Є –≤–Њ –≤–Ј—А–Њ—Б–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ.¬† –Р–Ф–Ю, –≤ —Ж–µ–ї–Њ–Љ, —Б—З–Є—В–∞–µ—В—Б—П –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, —В.–Ї. –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±—Л—З–љ–Њ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ—Л. –Ю–і–љ–∞–Ї–Њ —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –Р–Ф–Ю —И–Є—А–Њ–Ї–Њ –≤–∞—А—М–Є—А—Г—О—В—Б—П: –Њ—В –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –і–Њ —Б–ї—Г—З–∞–µ–≤ —В—П–ґ–µ–ї—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є, –µ—Б–ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ—А–Њ—П–≤–Є–ї–Њ—Б—М –≤ —А–∞–љ–љ–µ–Љ –≤–Њ–Ј—А–∞—Б—В–µ.
–Ш, –љ–∞–Ї–Њ–љ–µ—Ж, –•-—Б—Ж–µ–њ–ї–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј —П–≤–ї—П–µ—В—Б—П –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ–є —Д–Њ—А–Љ–Њ–є, –Є –Ј–∞ –≤—Б—О –Є—Б—В–Њ—А–Є—О –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤—Б–µ–≥–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–ї—Г—З–∞–µ–≤ —Б—А–µ–і–Є –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Ф–µ—Д–Є—Ж–Є—В –Ї–∞—А–±–Њ–љ–≥–Є–і—А–∞–Ј—Л II (CA II) вАУ –њ–µ—А–≤–∞—П —Д–Њ—А–Љ–∞ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–Њ–Љ. –Я–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –±–Є–Њ–Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –Њ—Ж–µ–љ–Ї–Є —Н–љ–Ј–Є–Љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ч–∞—В–µ–Љ —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А—П–Љ–Њ–≥–Њ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є—П –≥–µ–љ–∞ CA II —Г–і–∞–ї–Њ—Б—М –Њ–њ—А–µ–і–µ–ї–Є—В—М –Ї–Њ–љ–Ї—А–µ—В–љ—Г—О –Љ—Г—В–∞—Ж–Є—О. –° 2000 –≥–Њ–і–∞ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П –±–∞–Ј–∞ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞—Б—И–Є—А–Є–ї–∞—Б—М, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–∞—В—М –≥–µ–љ–µ—В–Є—З–µ—Б–Ї—Г—О –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О –њ—А–Є–Љ–µ—А–љ–Њ –≤ 90 % —Б–ї—Г—З–∞—П—Е. –Я—А–Є —Н—В–Њ–Љ –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Б–ї—Г—З–∞–Є –≤—Б–µ –µ—Й–µ –љ—Г–ґ–і–∞—О—В—Б—П –≤ —В–Њ—З–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ. –Т —Б–ї—Г—З–∞–µ ¬Ђ—З–Є—Б—В–Њ–≥–Њ¬ї –Р–†–Ю, –±–Њ–ї–µ–Ј–љ—М –≤—Л–Ј—Л–≤–∞—О—В –±–Є–∞–ї–ї–µ–ї—М–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –Њ–і–љ–Њ–Љ –Є–Ј 7 —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–µ–љ–Њ–≤: 5 –Є–Ј –љ–Є—Е (TCIRG1, CLCN7, OSTM1, SNX10, and PLEKHM1) –Ї–Њ–і–Є—А—Г—О—В –њ—А–Њ—В–µ–Є–љ—Л, –Ј–∞–і–µ–є—Б—В–≤–Њ–≤–∞–љ–љ—Л–µ –≤ –Њ–Ї–Є—Б–ї–µ–љ–Є–Є —А–µ–Ј–Њ—А–±—Ж–Є–Њ–љ–љ—Л—Е –ї–∞–Ї—Г–љ –Є/–Є–ї–Є –≤–µ–Ј–Є–Ї—Г–ї—П—А–љ–Њ–Љ —В—А–∞–љ—Б–њ–Њ—А—В–µ. –Ь—Г—В–∞—Ж–Є–Є –њ–Њ—В–µ—А–Є —Д—Г–љ–Ї—Ж–Є–Є –≤ –і–∞–љ–љ—Л—Е –≥–µ–љ–∞—Е –њ—А–Є–≤–Њ–і—П—В –Ї –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј—Г —Б –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –Љ–љ–Њ–≥–Њ, –љ–Њ –Њ–љ–Є –љ–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П, –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ ¬†TNFSF11 (RANK) –Є –µ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П —Б –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≥–µ–љ–µ–Ј –±–ї–Њ–Ї–Є—А—Г–µ—В—Б—П.
–Р–Ф–Ю I –Є II —В–Є–њ–∞ –Њ—В–ї–Є—З–∞—О—В—Б—П –њ–Њ –Ї–ї—О—З–µ–≤—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ (–Њ—Б–љ–Њ–≤–љ—Л–Љ –Њ—З–∞–≥–∞–Љ –њ–Њ–љ–Є–ґ–µ–љ–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Ї –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ–µ—А–µ–ї–Њ–Љ–∞–Љ) –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–Љ—Г –і–µ—Д–µ–Ї—В—Г, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–Љ—Г –≤ –≥–µ–љ–∞—Е LPR5 –Є CLCN7, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Р–Ф–Ю I —В–Є–њ–∞ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Є–Ј-–Ј–∞ –љ–∞—А—Г—И–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤ –њ–Њ –њ—А–Є—З–Є–љ–µ —Б–љ–Є–ґ–µ–љ–Є—П –∞—Д—Д–Є–љ–љ–Њ—Б—В–Є LPR5 –Ї –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–Љ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ SOST –Є DKK1 –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–∞–љ–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–≥–љ–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л Wnt, –±—Л–ї–Њ –±—Л —В–Њ—З–љ–µ–µ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –µ–≥–Њ –Ї–∞–Ї —Д–Њ—А–Љ—Г —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ, –њ–Њ—Б–ї–µ–і–љ–Є–µ –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ—Г—В–∞—Ж–Є–є –≥–µ–љ–∞ LRP5 –≤ –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –љ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –•-—Б—Ж–µ–њ–ї–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј –≤—Л–Ј—Л–≤–∞—О—В –≥–Є–њ–Њ–Љ–Њ—А—Д–Є—З–µ—Б–Ї–Є–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ NEMO (—Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ—Л–є –Љ–Њ–і—Г–ї—П—В–Њ—А NF-kB).
–Т –і–∞–љ–љ–Њ–є —Б—В–∞—В—М–µ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ—Л —Б–∞–Љ—Л–µ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ, —А–∞—Б—И–Є—А—П—О—Й–Є–µ —Б–њ–µ–Ї—В—А –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј—Г. –Т–Ї—А–∞—В—Ж–µ –Њ–њ–Є—Б–∞–љ—Л –љ–Њ–≤—Л–µ –Љ—Г—В–∞—Ж–Є–Є, –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–µ –≤ –≤—Л—И–µ—Г–њ–Њ–Љ—П–љ—Г—В—Л—Е –≥–µ–љ–∞—Е. –Я—А–Є —Н—В–Њ–Љ –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї–µ–љ–Њ –љ–Њ–≤—Л–Љ —В–Є–њ–∞–Љ –Љ—Г—В–∞—Ж–Є–є, –Ї–Њ—В–Њ—А—Л–µ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –Њ—Б–ї–Њ–ґ–љ—П—О—В –≤—Л–±–Њ—А –≤–∞—А–Є–∞–љ—В–Њ–≤ –њ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л–Љ –Ї—А–Є—В–µ—А–Є—П–Љ –≤ —Е–Њ–і–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Ґ–∞–Ї–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–Њ–≤—Л–µ –≥–µ–љ—Л, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ —Г –Њ–і–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ь–Њ–ї–µ–Ї—Г–ї—Л –Є —Б–Є–≥–љ–∞–ї—М–љ—Л–µ –њ—Г—В–Є, —Г–њ–Њ–Љ—П–љ—Г—В—Л–µ –≤ —Б—В–∞—В—М–µ, –Ї–∞–Ї –Є–≥—А–∞—О—Й–Є–µ —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.
–Ь—Г—В–∞—Ж–Є–Є –Є–Ј–≤–µ—Б—В–љ—Л—Е –≥–µ–љ–Њ–≤
TCIRG1
–У–µ–љ TCIRG1 (–Є–Љ–Љ—Г–љ–Њ—А–µ–≥—Г–ї—П—В–Њ—А –Ґ-–Ї–ї–µ—В–Њ–Ї 1) –Ї–Њ–і–Є—А—Г–µ—В a3-—Б—Г–±—К–µ–і–Є–љ–Є—Ж—Г V0-–і–Њ–Љ–µ–љ–∞ –Р–Ґ–§-–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –њ—А–Њ—В–Њ–љ–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ V-–Р–Ґ–§–∞–Ј—Л. –С–Њ–ї—М—И–µ –≤—Б–µ–≥–Њ –і–∞–љ–љ—Л–є –≥–µ–љ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –≤ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–∞—Е –Є –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –ґ–µ–ї—Г–і–Ї–∞: –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М V-–Р–Ґ–§–∞–Ј—Л —В—А–µ–±—Г–µ—В—Б—П –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –љ–Є–Ј–Ї–Њ–≥–Њ pH, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –љ–µ–Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ —А–∞–Ј—А—Г—И–µ–љ–Є—П –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Ї–Њ—Б—В–Є –Ї–Є—Б–ї—Л–Љ–Є –њ—А–Њ—В–µ–∞–Ј–∞–Љ–Є; –≤ –ґ–µ–ї—Г–і–Ї–µ –Њ–љ–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В –љ–Є–Ј–Ї–Є–є pH, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –і–ї—П –∞–±—Б–Њ—А–±—Ж–Є–Є –њ–Є—Й–µ–≤–Њ–≥–Њ Ca2+. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Н—В–Њ –Њ–±—К—П—Б–љ—П–µ—В –і–µ—Д–µ–Ї—В –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї–Њ—Б—В–Є –Є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—О –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ –Є —А–∞—Е–Є—В–∞ (—В.–љ. –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ—А–∞—Е–Є—В) –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Љ—Г—В–∞—Ж–Є–Є TCIRG1.
–Я–Њ–Љ–Є–Љ–Њ —Б–≤–Њ–µ–є —Д—Г–љ–Ї—Ж–Є–Є –њ—А–Њ—В–Њ–љ–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞, V0-–Ї–Њ–Љ–њ–ї–µ–Ї—Б —Г—З–∞—Б—В–≤—Г–µ—В –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–Љ –њ–µ—А–µ–Љ–µ—Й–µ–љ–Є–Є –њ—Г–Ј—Л—А—М–Ї–Њ–≤, —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—П —Б –Љ–Є–Ї—А–Њ—В—А—Г–±–Њ—З–Ї–∞–Љ–Є –Є –∞–Ї—В–Є–љ–Њ–≤—Л–Љ —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–Њ–Љ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б –њ–Њ–Љ–Њ—Й—М—О a3-—Б—Г–±—К–µ–і–Є–љ–Є—Ж—Л, –Є —Н—В–Њ –Є–≥—А–∞–µ—В –≤–∞–ґ–љ–µ–є—И—Г—О —А–Њ–ї—М –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —Д–µ—Б—В–Њ–љ—З–∞—В–Њ–≥–Њ –Ї—А–∞—П.
–Ь—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ TCIRG1 –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П —Б 50 % –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Р–†–Ю –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П—О—В—Б—П –њ–Њ –≤—Б–µ–Љ—Г –≥–µ–љ—Г, –≤—Л–Ј—Л–≤–∞—П –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ—А–Њ—В–Њ–љ–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ V-–Р–Ґ–§–∞–Ј—Л, –∞ —В–∞–Ї–ґ–µ –њ–µ—А–µ–Љ–µ—Й–µ–љ–Є—П/—Б–ї–Є—П–љ–Є—П –њ—Г–Ј—Л—А—М–Ї–Њ–≤ –≤ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–∞—Е.
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Њ–њ–Є—Б–∞–љ–Њ –±–Њ–ї–µ–µ 120 —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є –≥–µ–љ–∞ TCIRG1, –≤–Ї–ї—О—З–∞—П –Љ–Є—Б—Б–µ–љ—Б-–Љ—Г—В–∞—Ж–Є–Є, —Б—В–Њ–њ-–Љ—Г—В–∞—Ж–Є–Є, –Љ–∞–ї—Л–µ –Є–љ—Б–µ—А—Ж–Є–Є/–і–µ–ї–µ—Ж–Є–Є, –Ї—А—Г–њ–љ—Л–µ –≥–µ–љ–Њ–Љ–љ—Л–µ –і–µ–ї–µ—Ж–Є–Є –Є –і–µ—Д–µ–Ї—В—Л —Б–њ–ї–∞–є—Б–Є–љ–≥–∞, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –≤—Л—Б–Њ–Ї–Њ–є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В–Є –Ї–Њ–≥–Њ—А—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б TCIRG1-–і–µ—Д–µ–Ї—В–љ—Л–Љ –Р–†O. –≠—В–Њ—В —Д–∞–Ї—В —В–∞–Ї–ґ–µ –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –љ–µ–і–∞–≤–љ–Є–Љ–Є –Њ—В—З–µ—В–∞–Љ–Є –Њ–± –Њ—В–і–µ–ї—М–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–∞—Е –Є –љ–µ–±–Њ–ї—М—И–Є—Е –≥—А—Г–њ–њ–∞—Е, —П–≤–ї—П—О—Й–Є—Е—Б—П –љ–Њ—Б–Є—В–µ–ї—П–Љ–Є –љ–Њ–≤—Л—Е TCIRG1-–Љ—Г—В–∞—Ж–Є–є. –Э–µ–і–∞–≤–љ–Њ –∞–≤—В–Њ—А–∞–Љ–Є —Б—В–∞—В—М–Є –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –Є–љ—В–µ—А–µ—Б–љ—Л–µ —Б–≤–µ–і–µ–љ–Є—П –њ–Њ –і–∞–љ–љ–Њ–Љ—Г –≤–Њ–њ—А–Њ—Б—Г: –≤ –њ–µ—А–≤–Њ–Љ –Њ—В—З–µ—В–µ –Њ–њ–Є—Б–∞–љ—Л 4 —А–∞–Ј–ї–Є—З–љ—Л—Е –љ—Г–Ї–ї–µ–Њ—В–Є–і–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ 15 –Є–љ—В—А–Њ–љ–µ, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ–Љ –љ–∞ —Г–і–∞–ї–µ–љ–Є–Є –њ—А–Є–Љ–µ—А–љ–Њ 150 –љ—Г–Ї–ї–µ–Њ—В–Є–і–Њ–≤ –Њ—В –±–ї–Є–ґ–∞–є—И–µ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–∞–љ–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ –Њ–љ–Є –њ–Њ–ї—Г—З–Є–ї–Є –љ–∞–Ј–≤–∞–љ–Є–µ ¬Ђ–≥–ї—Г–±–Њ–Ї–Є–µ –Є–љ—В—А–Њ–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є¬ї. –Ф–∞–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –љ–∞—А—Г—И–∞—О—В –њ—А–Њ—Ж–µ—Б—Б —Б–њ–ї–∞–є—Б–Є–љ–≥–∞ –Є–Ј-–Ј–∞ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї—А–Є–њ—В–Є—З–µ—Б–Ї–Є—Е —Б–∞–є—В–Њ–≤ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞. –Я—А–Є —Н—В–Њ–Љ –љ–Њ—А–Љ–∞–ї—М–љ—Л–є —Б–њ–ї–∞–є—Б–Є–љ–≥ –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О, —З—В–Њ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ–Є—В—М –±–Њ–ї–µ–µ –Љ—П–≥–Ї–Є–є —Д–µ–љ–Њ—В–Є–њ –≤ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —Б–≤–µ–і–µ–љ–Є—П –њ–Њ–і—З–µ—А–Ї–Є–≤–∞—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —В—Й–∞—В–µ–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Є–љ—В—А–Њ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Є–Ј–≤–µ—Б—В–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ—В–≤–Њ—А–љ—Л—Е –≥–µ–љ–∞—Е.
–Т –і—А—Г–≥–Њ–є —Б—В–∞—В—М–µ –Њ–њ–Є—Б–∞–љ—Л —Б—Е–Њ–і–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ 12 —Н–Ї–Ј–Њ–љ–µ TCIRG1, –Ї–Њ—В–Њ—А—Л–є —Д–Њ—А–Љ–Є—А—Г–µ—В –≤–љ—Г—В—А–µ–љ–љ–Є–є –∞–Ї—Ж–µ–њ—В–Њ—А–љ—Л–є —Б–∞–є—В —Б–њ–ї–∞–є—Б–Є–љ–≥–∞ –≤ 12 —Н–Ї–Ј–Њ–љ–µ, –≤—Л–Ј—Л–≤–∞—П –∞–±–µ—А—А–∞—Ж–Є—О —Б–њ–ї–∞–є—Б–Є–љ–≥–∞, —Б–і–≤–Є–≥ —А–∞–Љ–Ї–Є –Є –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Г—О —В–µ—А–Љ–Є–љ–∞—Ж–Є—О, –Њ —З–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –≤–Є—А—В—Г–∞–ї—М–љ—Л–є —Б–Ї—А–Є–љ–Є–≥ –Є –Љ–Є–љ–Є–≥–µ–љ–љ—Л–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є. –Я–Њ–і–Њ–±–љ—Л–є –і–µ—Д–µ–Ї—В –±—Л–ї –Њ–±–љ–∞—А—Г–ґ–µ–љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–†–Ю, –≤—Л–Ј–≤–∞–љ–љ—Л–Љ –Љ—Г—В–∞—Ж–Є–µ–є –≥–µ–љ–∞ CLCN7 (—Б–Љ. –љ–Є–ґ–µ). –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–Њ–≥–ї–∞—Б—Г—О—В—Б—П —Б –њ–Њ—Б–ї–µ–і–љ–Є–Љ–Є –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є.
–Ґ–∞–±–ї–Є—Ж–∞ 1. –У–µ–љ—Л, —Г—З–∞—Б—В–≤—Г—О—Й–Є–µ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ –Є —Б–Љ–µ–ґ–љ—Л—Е –Њ—Б—В–µ–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞—Е.
–У–µ–љ |
–Э–∞—А—Г—И–∞–µ–Љ–∞—П —Д—Г–љ–Ї—Ж–Є—П –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–І–∞—Б—В–Њ—В–∞ |
–Ґ–Є–њ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ |
–Ґ–µ—А–∞–њ–Є—П |
TCIRG1 |
–Ъ–Є—Б–ї–Њ—В–љ–∞—П —Б–µ–Ї—А–µ—Ж–Є—П
–Т–µ–Ј–Є–Ї—Г–ї—П—А–љ—Л–є —В—А–∞–љ—Б–њ–Њ—А—В |
50 %b |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Ґ–У–°–Ъ |
CLCN7 |
–Ю–Ї–Є—Б–ї–µ–љ–Є–µ –ї–Є–Ј–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ |
17,5b (AP–Ю)
80 % (–Р–Ф–Ю) |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Ґ–У–°–Ъ –і–ї—П —Б–ї—Г—З–∞–µ–≤ –Р–Ф–Ю—Б, —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ |
SNX10 |
–≠–љ–і–Њ–ї–Є–Ј–Њ—Б–Њ–Љ–∞–ї—М–љ—Л–є —В—А–∞–љ—Б–њ–Њ—А—В/—Б–ї–Є—П–љ–Є–µ |
4,5 %b |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Ґ–У–°–Ъ |
OSTM1 |
–Ю–Ї–Є—Б–ї–µ–љ–Є–µ –ї–Є–Ј–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ |
5 %b |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В |
PLEKHM1 |
–≠–љ–і–Њ–ї–Є–Ј–Њ—Б–Њ–Љ–∞–ї—М–љ—Л–є —В—А–∞–љ—Б–њ–Њ—А—В/—Б–ї–Є—П–љ–Є–µ |
2 –њ–∞—Ж.b (–Р–†–Ю)
2 –њ–∞—Ж. (–Р–Ф–Ю) |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–°–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ |
CAII |
–Ю–Ї–Є—Б–ї–µ–љ–Є–µ |
<1:106 |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Ґ–У–°–Ъ—Б |
FERMT3 |
–°–ї–Є–њ–∞–љ–Є–µ –Є —А–∞—Б–њ–ї–∞—Б—В—Л–≤–∞–љ–Є–µ |
10 –њ–∞—Ж. |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Ґ–У–°–Ъ |
RANKL |
–Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—П –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
2 %b |
–° –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В |
RANK |
–Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—П –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
4.5 %b |
|
–Ґ–У–°–Ъ |
SLC29A3 |
–≠–љ–і–Њ–ї–Є–Ј–Њ—Б–Њ–Љ–∞–ї—М–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П |
3 –њ–∞—Ж. |
–° –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–њ–Њ–і–ї–µ–ґ–Є—В —Г—В–Њ—З–љ–µ–љ–Є—О |
TRAF6 |
–°–ї–Є–њ–∞–љ–Є–µ –Є —А–µ–Ј–Њ—А–±—Ж–Є—Пa |
2 –њ–∞—Ж. |
–° –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–њ–Њ–і–ї–µ–ґ–Є—В —Г—В–Њ—З–љ–µ–љ–Є—О |
LRRK1 |
–Ч–Њ–љ–∞ —Г–њ–ї–Њ—В–љ–µ–љ–Є—П –Є –Њ–±–ї–∞—Б—В—М —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Д–µ—Б—В–Њ–љ—З–∞—В–Њ–≥–Њ –Ї—А–∞—Пa |
1 –њ–∞—Ж. |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–њ–Њ–і–ї–µ–ґ–Є—В —Г—В–Њ—З–љ–µ–љ–Є—О |
MITF |
–Ъ–Њ–љ—В—А–Њ–ї—М –≥–µ–љ–љ–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Єa |
2 –њ–∞—Ж |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–њ–Њ–і–ї–µ–ґ–Є—В —Г—В–Њ—З–љ–µ–љ–Є—О |
NEMO |
Oc-–і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—П/–∞–Ї—В–Є–≤–∞—Ж–Є—П |
6 –њ–∞—Ж. |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–Ґ–У–°–Ъ |
RELA |
–Ю—Б-–і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—П |
1 –њ–∞—Ж. |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–њ–Њ–і–ї–µ–ґ–Є—В —Г—В–Њ—З–љ–µ–љ–Є—О |
CSFIR |
–Ю—Б-–і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—П |
2 –њ–∞—Ж. |
–° –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–њ–Њ–і–ї–µ–ґ–Є—В —Г—В–Њ—З–љ–µ–љ–Є—О |
C16ORF57 |
–Я–Њ–і–ї–µ–ґ–Є—В —Г—В–Њ—З–љ–µ–љ–Є—О |
2 –њ–∞—Ж. |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–°–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ |
CTSK |
–Ф–µ–≥—А–∞–і–∞—Ж–Є—П –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ |
1-1,7:106 |
–° –Є–Ј–±—Л—В–Ї–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ |
–°–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ |
a –Ф–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е
b–Я—А–Њ—Ж–µ–љ—В–љ–∞—П –і–Њ–ї—П —Б–Њ–≥–ї–∞—Б–љ–Њ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –і–∞–љ–љ—Л–Љ –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –Ї–Њ–≥–Њ—А—В–µ: 420 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–†–Ю
—Б–Ґ–У–°–Ъ –њ—А–Є–Љ–µ–љ–Є–Љ–∞ —В–Њ–ї—М–Ї–Њ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –љ–µ–є—А–Њ–і–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є.
CLCN7
–У–µ–љ CLCN7 (–њ–Њ—В–µ–љ—Ж–Є–∞–ї-–Ј–∞–≤–Є—Б–Є–Љ—Л–є —Е–ї–Њ—А–Є–і–љ—Л–є –Ї–∞–љ–∞–ї-7) –Ї–Њ–і–Є—А—Г–µ—В —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ–Љ—Л–є, –Љ–µ–і–ї–µ–љ–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї вАУ –Ј–∞–≤–Є—Б–Є–Љ—Л–є –Ї–∞–љ–∞–ї-–∞–љ—В–Є–њ–Њ—А—В–µ—А 2ClвИТ /1H+, –Ї–Њ—В–Њ—А—Л–є –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –Љ–µ–Љ–±—А–∞–љ–µ –њ–Њ–Ј–і–љ–Є—Е —Н–љ–і–Њ—Б–Њ–Љ –Є –ї–Є–Ј–Њ—Б–Њ–Љ. –≠—В–Њ—В –≥–µ–љ —Б–ї—Г–ґ–Є—В –њ–Њ—Б—А–µ–і–љ–Є–Ї–Њ–Љ –≤ –Њ–±–Љ–µ–љ–µ —Е–ї–Њ—А–Є–і–љ—Л—Е –Є–Њ–љ–Њ–≤ –Є –њ—А–Њ—В–Њ–љ–Њ–≤, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—П —Б–≤—П–Ј—М —Б V-–Р–Ґ–§–∞–Ј–Њ–є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Њ–Ї–Є—Б–ї–µ–љ–Є—П —А–µ–Ј–Њ—А–±—Ж–Є–Њ–љ–љ—Л—Е –ї–∞–Ї—Г–љ –Є –≤–µ–Ј–Є–Ї—Г–ї —Б –ї–Є–Ј–Њ—Б–Њ–Љ–∞–Љ–Є. CLCN7 –≤—Л—Б—В—Г–њ–∞–µ—В –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Є–Љ–µ—А–∞: –Ї–∞–ґ–і—Л–є –Љ–Њ–љ–Њ–Љ–µ—А —Б–Њ–і–µ—А–ґ–Є—В –њ—Г—В—М –Є–Њ–љ–љ–Њ–є —В—А–∞–љ—Б–ї–Њ–Ї–∞—Ж–Є–Є —Б –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ—Л–Љ –Є–Њ–љ–Њ—В—А–Њ–њ–љ—Л–Љ –≥–ї—Г—В–∞–Љ–∞—В–љ—Л–Љ –Њ—Б—В–∞—В–Ї–Њ–Љ –Є –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ—Л–µ –њ–µ—А–µ—Б—В—А–Њ–є–Ї–Є –≤–љ–µ –Є–Њ–љ–љ—Л—Е –њ—Г—В–µ–є –њ—А–Є–≤–Њ–і—П—В –Ї —Б–Є–љ—Е—А–Њ–љ–љ–Њ–Љ—Г –Њ—В–Ї—А—Л—В–Є—О –Њ–±–Њ–Є—Е –Ї–∞–љ–∞–ї–Њ–≤.
–†–µ—Ж–µ—Б—Б–Є–≤–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ —П–≤–ї—П—О—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –Њ–Ї–Њ–ї–Њ 17 % –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Р–†–Ю, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–µ вАУ –њ—А–Є—З–Є–љ–Њ–є –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Б–ї—Г—З–∞–µ–≤ –Р–Ф–Ю II —В–Є–њ–∞.
–Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Њ–≤—Л—Е –Љ—Г—В–∞—Ж–Є–є CLCN7 –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–≥–Є–Њ–љ–Њ–≤ (–Ъ–Є—В–∞–є, –Ґ–∞–є–≤–∞–љ—М, –ѓ–њ–Њ–љ–Є—П, –≠–Ї–≤–∞–і–Њ—А, –Ш—В–∞–ї–Є—П, –Ь–∞—А–Њ–Ї–Ї–Њ). –≠—В–Є –Љ—Г—В–∞—Ж–Є–Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Є—Б—М —Б–Њ –≤—Б–µ–Љ–Є –Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є CLCN7-–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞: —А–µ—Ж–µ—Б—Б–Є–≤–љ–Њ–є, –і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ–є –Є –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –љ–Њ–≤—Л—Е –Љ—Г—В–∞—Ж–Є–є —П–≤–ї—П–ї–Є—Б—М –њ—А–Є—З–Є–љ–Њ–є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В –Є –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г –µ–і–Є–љ–Є—З–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–ї–Є —Ж–µ–ї—Л—Е —Б–µ–Љ–µ–є. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, —Н—В–Њ –Њ–±—Г—Б–ї–Њ–≤–Є–ї–Њ –љ–µ–Ї–Њ—В–Њ—А—Г—О –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ—Б—В–Є –≤ –Є—Е –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є. –Я–Њ—Н—В–Њ–Љ—Г –њ–Њ–Є—Б–Ї –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Б–њ–Њ—Б–Њ–±–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–ї–Є—П–љ–Є—П CLCN7- –Љ—Г—В–∞—Ж–Є–є –љ–∞ —Д—Г–љ–Ї—Ж–Є–Є –±–µ–ї–Ї–Њ–≤ —П–≤–ї—П–µ—В—Б—П –љ–∞—Б—Г—Й–љ–Њ–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О, —З—В–Њ–±—Л —А–∞–Ј–ї–Є—З–∞—В—М —А–µ–і–Ї–Є–µ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ—Л –Є –Љ—Г—В–∞—Ж–Є–Є –Є –њ—А–∞–≤–Є–ї—М–љ–Њ —Б–Њ—Б—В–∞–≤–ї—П—В—М –Ї–Њ—А–µ–ї–ї—П—Ж–Є—О –≥–µ–љ–Њ—В–Є–њ-—Д–µ–љ–Њ—В–Є–њ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ї–∞–Ї —Г–њ–Њ–Љ–Є–љ–∞–ї–Њ—Б—М –≤—Л—И–µ, –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Б–Є–љ–Њ–љ–Є–Љ–Є—З–љ—Л–є –≤–∞—А–Є–∞–љ—В –≤ 12 —Н–Ї–Ј–Њ–љ–µ CLCN7, –≤—Л–Ј—Л–≤–∞—О—Й–Є–є —З–∞—Б—В–Є—З–љ—Г—О –∞–±–µ—А—А–∞—Ж–Є—О —Б–њ–ї–∞–є—Б–Є–љ–≥–∞ —Б –њ—А–Њ–њ—Г—Б–Ї–Њ–Љ 12 —Н–Ї–Ј–Њ–љ–∞ –≤–љ—Г—В—А–Є —А–∞–Љ–Ї–Є. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —Б–≤–µ–і–µ–љ–Є—П –њ—А–Є–≤–µ–ї–Є –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О –≥–Є–њ–Њ—В–µ–Ј—Л –Њ —В–Њ–Љ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Б–Є–љ–Њ–љ–Є–Љ–Є—З–љ—Л–µ, –љ–Њ –љ–µ —П–≤–љ–Њ –њ–∞—В–Њ–≥–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–њ–Њ—Б–Њ–±–љ—Л –Љ–Њ–і—Г–ї–Є—А–Њ–≤–∞—В—М —Д–µ–љ–Њ—В–Є–њ –Љ—Г—В–∞—Ж–Є–є CLCN7. –Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —Н—В–Њ–є —В–µ–Њ—А–Є–Є –Љ–Њ–ґ–µ—В –њ–Њ–љ–∞–і–Њ–±–Є—В—М—Б—П –∞–љ–∞–ї–Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е –Ї—А—Г–њ–љ–Њ–є –Ї–Њ–≥–Њ—А—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б CLCN7-–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ.
SNX10
–У–µ–љ SNX10 (—Б–Њ—А—В–Є—А—Г—О—Й–Є–є –љ–µ–Ї—Б–Є–љ 10) –Ї–Њ–і–Є—А—Г–µ—В –±–µ–ї–Њ–Ї, –Њ—В–љ–Њ—Б—П—Й–Є–є—Б—П –Ї —Б–µ–Љ–µ–є—Б—В–≤—Г SNX вАУ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Є –Љ–µ–Љ–±—А–∞–љ–Њ—Б–≤—П–Ј–∞–љ–љ—Л—Е –±–µ–ї–Ї–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е—Б—П –љ–∞–ї–Є—З–Є–µ–Љ —Д–Њ—Б—Д–Њ–Є–љ–Њ–Ј–Є—В–Є–і-—Б–≤—П–Ј—Л–≤–∞—О—Й–µ–≥–Њ –і–Њ–Љ–µ–љ–∞ PX. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, SNX-–±–µ–ї–Ї–Є —Г—З–∞—Б—В–≤—Г—О—В –≤ —Б–Њ—А—В–Є—А–Њ–≤–Ї–µ –±–µ–ї–Ї–Њ–≤ –Є –Љ–µ–Љ–±—А–∞–љ–љ–Њ–Љ —В—А–∞–љ—Б–њ–Њ—А—В–µ, —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—П —Б–≤—П–Ј–Є –±–µ–ї–Њ–Ї-–±–µ–ї–Њ–Ї –Є –±–µ–ї–Њ–Ї-–ї–Є–њ–Є–і. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, SNX10 –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б V-–Р–Ґ–§–∞–Ј–Њ–є –Є —А–µ–≥—Г–ї–Є—А—Г–µ—В –µ–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–є —В—А–∞–љ—Б–њ–Њ—А—В; —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ SNX10 –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞—А—Г—И–µ–љ–Є—П —В—А–∞–љ—Б–њ–Њ—А—В–∞ V-–Р–Ґ–§–∞–Ј—Л –Ї —Д–µ—Б—В–Њ–љ—З–∞—В–Њ–Љ—Г –Ї—А–∞—О –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤. –Ґ–∞–Ї–ґ–µ –≤ –Њ—З–µ–љ—М —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е SNX10 –Љ–Њ–ґ–µ—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –Є–≥—А–∞—В—М —А–Њ–ї—М –≤ —В—А–∞–љ—Б–њ–Њ—А—В–µ –Є —Б–µ–Ї—А–µ—Ж–Є–Є –Љ–∞—В—А–Є–Ї—Б–љ–Њ–є –Љ–µ—В–∞–ї–ї–њ—А–Њ—В–µ–∞–Ј—Л 9 –њ—А–Є –і–µ–≥—А–∞–і–∞—Ж–Є–Є –≤–љ–µ—И–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞.
–Ь—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ SNX10 —Б–ї—Г–ґ–∞—В –њ—А–Є—З–Є–љ–Њ–є –Њ–Ї–Њ–ї–Њ 5 % –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Р–†–Ю, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —В.–љ. –Т–µ—Б—В–µ—А–±–Њ—В—В–µ–љ—Б–Ї–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ (–њ–Њ –љ–∞–Ј–≤–∞–љ–Є—О –њ—А–Њ–≤–Є–љ—Ж–Є–Є –≤ –®–≤–µ—Ж–Є–Є —Б –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П). –Т —З–∞—Б—В–љ–Њ—Б—В–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤–∞—А–Є–∞–љ—В SNX10 c.212+1G>T, –≤—Л–Ј—Л–≤–∞—О—Й–Є–є –∞–Ї—В–Є–≤–∞—Ж–Є—О –Ї—А–Є–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–∞–є—В–∞ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞ –≤ 4-–Њ–Љ –Є–љ—В—А–Њ–љ–µ –Є –∞–±–µ—А—А–∞–љ—В–љ–Њ–≥–Њ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞, —П–≤–ї—П–µ—В—Б—П –Њ–±—Й–µ–є –Љ—Г—В–∞—Ж–Є–µ–є –і–ї—П –і–∞–љ–љ–Њ–є –Ї–Њ–≥–Њ—А—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б –љ–µ–Њ–±—Л–Ї–љ–Њ–≤–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –љ–Њ—Б–Є—В–µ–ї–µ–є (1:93) –≤ –Њ–±—Й–µ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Т–µ—Б—В–µ—А–±–Њ—В—В–µ–љ–∞. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –≥–µ–љ–µ–∞–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –≥–∞–њ–ї–Њ–Є–і–љ—Л–є –∞–љ–∞–ї–Є–Ј —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –≤ –њ–Њ–ї—М–Ј—Г –љ–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–∞–љ–љ–Њ–є –Љ—Г—В–∞—Ж–Є–Є –Њ—В –Њ–±—Й–Є—Е –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –≤ –љ–∞—З–∞–ї–µ 19-–≥–Њ –≤–µ–Ї–∞.
–Э–∞ –Ї–ї–µ—В–Њ—З–љ–Њ–Љ —Г—А–Њ–≤–љ–µ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–∞–љ–µ–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ –њ–Њ–≤–Њ–і—Г –љ–∞–ї–Є—З–Є—П –Є–ї–Є –љ–µ—Е–≤–∞—В–Ї–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –њ—А–Є –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ SNX-10, –°—В–∞—В—В–Є–љ —Б —Б–Њ–∞–≤—В. –≥–Њ–≤–Њ—А—П—В –љ–µ –Њ –і–µ—Д–µ–Ї—В–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –≤ –Ь–Ъ–Я–Ъ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ –Њ –љ–∞—А—Г—И–µ–љ–Є–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Д–µ—Б—В–Њ–љ—З–∞—В–Њ–≥–Њ –Ї—А–∞—П. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П, –Њ—Б—В–∞–µ—В—Б—П –њ–Њ–і –≤–Њ–њ—А–Њ—Б–Њ–Љ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, —З—В–Њ —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є—П SNX10 –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–љ–Њ–Љ—Г —А–∞—Е–Є—В—Г¬† (–Њ —З–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ –Љ—Л—И–Є–љ–Њ–є –Љ–Њ–і–µ–ї–Є), –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –ї–Є—И—М —Г –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –і–∞–љ–љ—Л–є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є —Д–µ–љ–Њ—В–Є–њ. –Т –Њ—З–µ–љ—М —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ–ї—О—А–Є–њ–Њ—В–µ–љ—В–љ—Л–µ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є (–Ш–Я–°–Ъ) –њ–µ—А–µ–њ—А–Њ–≥—А–∞–Љ–Љ–Є—А—Г—О—В—Б—П –Є–Ј –Ї–Њ–ґ–љ—Л—Е —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ (—Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Љ—Г—В–∞—Ж–Є–µ–є c.212+1G>T). –Ф–∞–љ–љ—Л–µ –Ш–Я–°–Ъ –Љ–Њ–≥—Г—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –Є–Ј—Г—З–µ–љ–Є—О –љ–µ —А–∞—Б–Ї—А—Л—В—Л—Е –і–Њ –Ї–Њ–љ—Ж–∞ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є SNX10-–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞.
OSTM1
–У–µ–љ OSTM1 (–Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є —В—А–∞–љ—Б–Љ–µ–Љ–±—А–∞–љ–љ—Л–є –±–µ–ї–Њ–Ї 1) –Ї–Њ–і–Є—А—Г–µ—В —В—А–∞–љ—Б–Љ–µ–Љ–±—А–∞–љ–љ—Л–є –±–µ–ї–Њ–Ї I —В–Є–њ–∞, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–є, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ, –љ–∞ —Н–љ–і–Њ—Б–Њ–Љ–∞—Е –Є –ї–Є–Ј–Њ—Б–Њ–Љ–∞—Е. –Ю–љ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Њ –≥–ї–Є–Ї–Њ–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ N-–Ї–Њ–љ—Ж–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г–µ—В CLCN7 –Є –Ј–∞—Й–Є—Й–∞–µ—В –µ–≥–Њ –Њ—В –і–µ–≥—А–∞–і–∞—Ж–Є–Є –ї–Є–Ј–Њ—Б–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Њ–±–Љ–µ–љ–µ 2ClвИТ /1H+. –Ґ—А–∞–љ—Б–Љ–µ–Љ–±—А–∞–љ–љ—Л–є –і–Њ–Љ–µ–љ –Ј–∞–і–µ–є—Б—В–≤–Њ–≤–∞–љ –≤ –Є–Њ–љ–љ–Њ–Љ –Њ–±–Љ–µ–љ–µ –Є CLCN7-–Ј–∞–≤–Є—Б–Є–Љ–Њ–Љ —В—А–∞–љ—Б–њ–Њ—А—В–µ –Ї –ї–Є–Ј–Њ—Б–Њ–Љ–∞–Љ. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П —В–∞–Ї–ґ–µ, —З—В–Њ OSTM1 –і–µ–є—Б—В–≤—Г–µ—В –≤ –Ї–∞—З–µ—Б—В–≤–µ —Г–±–Є–Ї–≤–Є—В–Є–љ-–ї–Є–≥–∞–Ј—Л E3 –і–ї—П –≥–µ—В–µ—А–Њ—В—А–Є–Љ–µ—А–љ–Њ–≥–Њ G-–±–µ–ї–Ї–∞ Gќ±i3 –Є —Г—Б–Є–ї–Є–≤–∞–µ—В –Ї–∞–љ–Њ–љ–Є—З–µ—Б–Ї–Є–є —Б–Є–≥–љ–∞–ї—М–љ—Л–є –њ—Г—В—М WNT —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–Њ–і—Г–ї—П—Ж–Є–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—П ќ≤-–Ї–∞—В–µ–љ–Є–љ/ Lef1.
–Э–µ–і–∞–≤–љ–Њ –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ —Ж–Є—В–Њ–Ј–Њ–ї—М–љ—Л–µ –њ–∞—А—В–љ–µ—А—Л OSTM1 –њ–Њ —Б–≤—П–Ј—Л–≤–∞–љ–Є—О, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ OSTM1 –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–і–∞–њ—В–Њ—А–љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –≤–љ—Г—В—А–Є —Ж–Є—В–Њ–Ј–Њ–ї—М–љ–Њ–≥–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–≥–Њ –Љ—Г–ї—М—В–Є–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞.
–Ь—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ OSTM1 —П–≤–ї—П—О—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –њ—А–Є–Љ–µ—А–љ–Њ 5 % –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Р–†–Ю –Є –≤—Б–µ–≥–і–∞ –≤—Л–Ј—Л–≤–∞—О—В –Ї—А–∞–є–љ–µ —В—П–ґ–µ–ї—Л–є —Д–µ–љ–Њ—В–Є–њ —Б –±—Л—Б—В—А–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –њ–µ—А–≤–Є—З–љ–Њ–є –љ–µ–є—А–Њ–і–≥–µ–љ–µ—А–∞—Ж–Є–µ–є. –Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –і–∞–љ–љ–Њ–≥–Њ –≥–µ–љ–∞ —П–≤–ї—П—О—В—Б—П –і–µ—Д–µ–Ї—В–∞–Љ–Є —Г—Б–µ—З–µ–љ–Є—П. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ, –њ—А–Є —Г—Б–µ—З–µ–љ–Є–Є OSTM1 –≤ —Б–Ї—А—Л—В–Њ–є —Д–Њ—А–Љ–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤
in vitro –њ—Г—В–µ–Љ —Б–љ–Є–ґ–µ–љ–Є—П —З–Є—Б–ї–∞ –Њ—Б–µ–є BLIMP1-NFATc1, —З—В–Њ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –њ—А–Є–≤–Њ–і–Є—В –Ї –і—А—Г–≥–Є–Љ –њ–∞—В–Њ–≥–µ–љ–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ –≤ —Б–ї—Г—З–∞–µ –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ OSTM1. –С–Њ–ї–µ–µ —В–Њ–≥–Њ,–±–ї–∞–≥–Њ–і–∞—А—П —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–Њ–Љ—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г –Я–¶–†-–∞–љ–∞–ї–Є–Ј—Г, –і–≤–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ—Л—Е –Љ–Є–Ї—А–Њ–і–µ–ї–µ—Ж–Є–Є, –њ–µ—А–µ–Ї—А—Л–≤–∞—О—Й–Є–µ ~ 110 –Є ~ 10 –Ї–± —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –Є –њ–Њ—А–∞–ґ–∞—О—Й–Є–µ N-—В–µ—А–Љ–Є–љ–∞–ї—М–љ—Л–є —Г—З–∞—Б—В–Њ–Ї –≥–µ–љ–∞ OSTM1, –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г 5 —В—П–ґ–µ–ї–Њ –±–Њ–ї—М–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј –і–≤—Г—Е –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е —Б–µ–Љ–µ–є –∞—А–∞–±—Б–Ї–Њ–≥–Њ –Є –Є–љ–і–Є–є—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П. –Р–љ–∞–ї–Є–Ј –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–µ–є —А–µ–ї–µ–≤–∞–љ—В–љ–Њ–≥–Њ –≥–µ–љ–Њ–Љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –≤—Л—П–≤–Є–ї AluSx-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Г—О —А–µ–Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Є –љ–µ—А–µ–Ї–Ї—Г—А–µ–љ—В–љ—Г—О –њ–µ—А–µ—Б—В—А–Њ–є–Ї—Г, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й—Г—О—Б—П –љ–µ–≥–Њ–Љ–Њ–ї–Њ–≥–Є—З–љ—Л–Љ —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ–Љ –Ї–Њ–љ—Ж–Њ–≤, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –ї–µ–ґ–∞—Й–Є–Љ –≤ –Њ—Б–љ–Њ–≤–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ.
–Ъ—А–∞–є–љ–µ —А–µ–і–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–њ–Є—Б—Л–≤–∞–µ—В—Б—П –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј —Б —А–∞–љ–љ–µ–є –љ–µ–є—А–Њ–і–µ–≥–µ–љ–µ—А–∞—Ж–Є–µ–є –Є –∞–Ї–Ї—Г–Љ—Г–ї—П—Ж–Є–µ–є –ґ–µ–ї–µ–Ј–∞ –≤ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –Њ–±–ї–∞—Б—В—П—Е –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –Ї—А–∞–є–љ–µ –љ–µ–Њ–±—Л—З–љ—Л–Љ —Б–ї—Г—З–∞–µ–Љ. –Я–Њ–ї–љ–Њ–µ —Н–Ї–Ј–Њ–Љ–љ–Њ–µ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ –≤—Л—П–≤–Є–ї–Њ –љ–Њ–≤—Л–µ c.783+5G>T –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ OSTM1, –≤—Л–Ј—Л–≤–∞—О—Й–Є–µ –њ—А–Њ–њ—Г—Б–Ї 4-–≥–Њ —Н–Ї–Ј–Њ–љ–∞, –∞ —В–∞–Ї–ґ–µ –Љ—Г—В–∞—Ж–Є–Є —Б–і–≤–Є–≥–∞ —А–∞–Љ–Ї–Є c.446dup –≤ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –≥–µ–љ–∞ MANEAL. –Ф–∞–љ–љ—Л–є –≥–µ–љ –Ї–Њ–і–Є—А—Г–µ—В —Н–љ–і–Њ-–∞–ї—М—Д–∞-–њ–Њ–і–Њ–±–љ—Л–є –±–µ–ї–Њ–Ї –Љ–∞–љ–љ–Њ–Ј–Є–і–∞–Ј—Л, –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ –≤ –∞–њ–њ–∞—А–∞—В–µ –У–Њ–ї—М–і–ґ–Є –Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –≤–Ї–ї—О—З–µ–љ –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–Є–љ–∞; –Є –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –≤ –Љ–Њ—З–µ –Є —Ж–µ—А–µ–±—А–Њ—Б–њ–Є–љ–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Љ–∞–љ–љ–Њ–Ј–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї —В–µ—В—А–∞—Б–∞—Е–∞—А–Є–і—Л. –Ф–Њ —Б–Є—Е –њ–Њ—А –љ–µ—П—Б–љ–Њ, –Ї–∞–Ї —Н—В–Њ —Б–Њ–Њ—В–љ–Њ—Б–Є—В—Б—П —Б –∞–Ї–Ї—Г–Љ—Г–ї—П—Ж–Є–µ–є –ґ–µ–ї–µ–Ј–∞ –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ. –Т–ї–Є—П–љ–Є–µ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ MANEAL –љ–∞ —Д–µ–љ–Њ—В–Є–њ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є —Б OSTM1, –≤ —Ж–µ–ї–Њ–Љ, —В—А–µ–±—Г–µ—В –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П.
PLEKHM1
–У–µ–љ PLEKHM1 (–њ–ї–µ–Ї—Б—В—А–Є–љ –≥–Њ–Љ–Њ–ї–Њ–≥–Є—З–љ–Њ–µ –і–Њ–Љ–µ–љ—Б–Њ–і–µ—А–ґ–∞—Й–µ–µ —Б–µ–Љ–µ–є—Б—В–≤–Њ –Ь вАУ —Б RUN –і–Њ–Љ–µ–љ–Њ–Љ 1) –Ї–Њ–і–Є—А—Г–µ—В —Ж–Є—В–Њ—Б–Њ–ї–Є—З–µ—Б–Ї–Є–є –±–µ–ї–Њ–Ї, –Ј–∞–і–µ–є—Б—В–≤–Њ–≤–∞–љ–љ—Л–є –≤ —Н–љ–і–Њ—Б–Њ–Љ–∞–ї—М–љ—Л—Е —В—А–∞–љ—Б–њ–Њ—А—В–љ—Л—Е –њ—Г—В—П—Е –≤–≤–Є–і—Г –≤–Ј–∞–Є–Љ–Њ–і–µ–є—В—Б–≤–Є—П —Б –Љ–∞–ї—Л–Љ–Є –У–Ґ–§–∞–Ј–∞–Љ–Є RAB7 –Є ARL8. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ, PLEKHM1 —Г—З–∞—Б—В–≤—Г–µ—В –≤ —Б–ї–Є—П–љ–Є–Є –∞—Г—В–Њ—Д–∞–≥–Њ—Б–Њ–Љ –Є –ї–Є–Ј–Њ—Б–Њ–Љ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–Љ –і–ї—П –Ї–ї–Є—А–µ–љ—Б–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –±–µ–ї–Ї–Њ–≤—Л—Е –∞–≥—А–µ–≥–∞—В–Њ–≤. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Н—В–Є–Љ, —А–∞–Ј—А—Г—И–µ–љ–Є–µ —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л—Е PLEKHM1-–і–Њ–Љ–µ–љ–Њ–≤ –Є–ї–Є –њ–Њ—В–µ—А—П PLEKHM1 –љ–∞—А—Г—И–∞–µ—В —Б–µ–Ї—А–µ—Ж–Є—О –Є –і–Њ—Б—В–∞–≤–Ї—Г –≤–µ–Ј–Є–Ї—Г–ї, –∞ —В–∞–Ї–ґ–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Д–µ—Б—В–Њ–љ—З–∞—В–Њ–≥–Њ –Ї—А–∞—П, —З—В–Њ —Г—Е—Г–і—И–∞–µ—В —А–µ–Ј–Њ—А–±—В–Є–≤–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤.
PLEKHM1 вАУ —Н—В–Њ –Ї—А—Г–њ–љ—Л–є –±–µ–ї–Њ–Ї, –Ї–Њ—В–Њ—А—Л–є —Б–Њ–і–µ—А–ґ–Є—В —А–∞–Ј–ї–Є—З–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –і–Њ–Љ–µ–љ—Л: –і–Њ–Љ–µ–љ RUN, –≥–і–µ –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ—Л –Љ—Г—В–∞—Ж–Є–Є (NM_014798.2:c.296+1G>A), –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —Г –і–≤—Г—Е —Б–Є–±–ї–Є–љ–≥–Њ–≤ —Б –Р–†–Ю; 2 –њ–ї–µ–Ї—Б—В—А–Є–љ-–≥–Њ–Љ–Њ–ї–Њ–≥–Є—З–љ—Л—Е (PH) –і–Њ–Љ–µ–љ–∞, –Њ—В–і–µ–ї–µ–љ–љ—Л—Е –і—А—Г–≥ –Њ—В –і—А—Г–≥–∞ LC3-–≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—Й–µ–є –Њ–±–ї–∞—Б—В—М—О (LIR); —А—Г–±–Є–Ї–Њ–љ-–≥–Њ–Љ–Њ–ї–Њ–≥–Є—З–љ—Л–є (RH) –і–Њ–Љ–µ–љ –Є ¬Ђ—Ж–Є–љ–Ї–Њ–≤—Л–є –њ–∞–ї–µ—Ж¬ї –°1 –≤ –Ї–∞—А–±–Њ–Ї—Б–Є–ї—М–љ–Њ–Љ –Ї–Њ–љ—Ж–µ. –Ф–≤–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ PLEKHM1 –≤—Л—П–≤–ї–µ–љ—Л —Г –і–≤—Г—Е –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤: –Љ—Г—В–∞—Ж–Є—П c.2140C>T:p.Arg714Cys, –љ–µ—П–≤–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–∞—П —Б –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ, –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –≤–Њ –≤—В–Њ—А–Њ–Љ PH-–і–Њ–Љ–µ–љ–µ; –Є –љ–µ–і–∞–≤–љ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –Љ—Г—В–∞—Ж–Є—П c.3051_3052delCA, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–∞—П –≤ RH-–і–Њ–Љ–µ–љ–µ –Є –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –ї–Є–Ї–≤–Є–і–Є—А—Г—О—Й–∞—П –Љ–Њ—В–Є–≤ —Ж–Є–љ–Ї–Њ–≤–Њ–≥–Њ –њ–∞–ї—М—Ж–∞. RH-–і–Њ–Љ–µ–љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ –і–ї—П –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П PLEKHM1 —Б RAB7; –≤ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ —Н—В–Њ–≥–Њ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–≤–µ—А—Е—Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≤ –Ї–ї–µ—В–Ї–∞—Е HEK293T –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б–љ–Є–ґ–µ–љ–Є–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Љ—Г—В–Є—А–Њ–≤–∞–≤—И–Є—Е –±–µ–ї–Ї–Њ–≤ —Б RAB7, –њ—А–Є–≤–Њ–і—П—Й–µ–µ –Ї –∞–љ–Њ–Љ–∞–ї—М–љ–Њ–є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є—О —Г—А–Њ–≤–љ—П –∞—Г—В–Њ—Д–∞–≥–Є–Є. –≠—В–Є —Б–≤–µ–і–µ–љ–Є—П –≤–љ–µ—Б–ї–Є –≤–∞–ґ–љ—Л–є –≤–Ї–ї–∞–і –≤ –њ–Њ–љ–Є–Љ–∞–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є PLEKHM1 –і–ї—П –±–Є–Њ–ї–Њ–≥–Є–Є –Ї–Њ—Б—В–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞—Б–њ–µ–Ї—В—Л –Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М —Б –∞—Г—В–Њ—Д–∞–≥–Є–µ–є, –Њ—Б—В–∞—О—В—Б—П —Б–њ–Њ—А–љ—Л–Љ–Є –Є –љ—Г–ґ–і–∞—О—В—Б—П –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Є–Ј—Г—З–µ–љ–Є–Є.
CAII
–У–µ–љ –°–РII –Ї–Њ–і–Є—А—Г–µ—В —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–Є—З–µ—Б–Ї–Є–є —Д–µ—А–Љ–µ–љ—В, –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г—О—Й–Є–є –њ–Њ–ї—Г—З–µ–љ–Є–µ H2CO3 —Б –њ–Њ–Љ–Њ—Й—М—О CO2 –Є H2O; –Ј–∞—В–µ–Љ, H2CO3 –і–Є—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В –љ–∞ HCO3 –Є –Є–Њ–љ—Л H+. –Я–Њ–ї—Г—З–µ–љ–љ—Л–є H+ –≤—Л—В–µ—Б–љ—П–µ—В—Б—П V-–Р–Ґ–§–∞–Ј–Њ–є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї HCO3 –њ–Њ–≥–ї–Њ—Й–∞–µ—В—Б—П HCO3 вИТ and H+ - –∞–љ–Є–Њ–љ–љ—Л–Љ –Њ–±–Љ–µ–љ–љ–Є–Ї–Њ–Љ, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ –≤ –±–∞–Ј–Њ–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ, –Ї–Њ—В–Њ—А–∞—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –∞–ї–Ї–∞–ї–Є–љ–Є–Ј–∞—Ж–Є—О —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ—Л –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –Є–Њ–љ—Л ClвИТ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ –і–ї—П CLCN7/OSTM1 2ClвИТ /H+ –∞–љ—В–Є–њ–Њ—А—В–µ—А–∞.
–Я–Њ–Љ–Є–Љ–Њ —В–Њ–≥–Њ, –≥–µ–љ CAII –≤ –±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –≤ –њ–Њ—З–Ї–∞—Е –Є –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, –њ–∞—Ж–Є–µ–љ—В—Л —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ CAII –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј, –њ–Њ—З–µ—З–љ—Л–є —В—Г–±—Г–ї—П—А–љ—Л–є –∞—Ж–Є–і–Њ–Ј (–Я–Ґ–Р) –Є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Г—О –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—Ж–Є—О, –Є –і–∞–љ–љ–∞—П —В—А–Є–∞–і–∞ –љ–∞—А—Г—И–µ–љ–Є–є —Б–∞–Љ–∞ –њ–Њ —Б–µ–±–µ —Д–Њ—А–Љ–Є—А—Г–µ—В –і–Є–∞–≥–љ–Њ–Ј. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ —В–Њ, —З—В–Њ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є –Я–Ґ–Р –љ–µ–і–∞–≤–љ–Њ –±—Л–ї –Њ–њ–Є—Б–∞–љ —В–∞–Ї–ґ–µ —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Р–Ф–Ю II, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П –љ–Њ—Б–Є—В–µ–ї–µ–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є –њ—А–Є –Р–Ф–Ю II p.Gly215Arg –Љ—Г—В–∞—Ж–Є–Є –Є —Г –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–µ –±—Л–ї–Њ –і—А—Г–≥–Є—Е –Љ—Г—В–∞—Ж–Є–є, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Я–Ґ–Р; –≤ –і–∞–љ–љ–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є —В–Њ—З–љ—Л–є –њ–∞—В–Њ–≥–µ–љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–Њ —Б–Є—Е –њ–Њ—А –Њ—Б—В–∞–µ—В—Б—П –љ–µ—П—Б–љ—Л–Љ.
–Т –њ—А–Њ—Ж–µ—Б—Б–µ —Б—В–∞–љ–і–∞—А—В–Є–Ј–∞—Ж–Є–Є —Г—Б–ї–Њ–≤–Є–є –і–ї—П –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤—Л—П–≤–ї–µ–љ–Њ –Њ–Ї–Њ–ї–Њ 30 —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є CAII: –Љ–Є—Б—Б–µ–љ—Б-–Љ—Г—В–∞—Ж–Є–Є, —Б—В–Њ–њ-–Љ—Г—В–∞—Ж–Є–Є –Є –Љ—Г—В–∞—Ж–Є–Є —Б–∞–є—В–∞ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞ (—Б—А–µ–і–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е - NM_000067.2:c.232+1G>A –Є–ї–Є —В.–љ. –∞—А–∞–±—Б–Ї–∞—П –Љ—Г—В–∞—Ж–Є—П, –Є–Ј-–Ј–∞ —И–Є—А–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –∞—А–∞–±—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П). –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ—Г—В–∞—Ж–Є–µ–є CAII –Є–Љ–µ—О—В –∞—А–∞–±—Б–Ї–Њ–µ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ, –Њ–і–љ–∞–Ї–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П —В–∞–Ї–ґ–µ –µ–≤—А–Њ–њ–µ–є—Ж—Л, –Є—Б–њ–∞–љ—Ж—Л, –∞—Д—А–Њ-–∞–Љ–µ—А–Ї–∞–љ—Ж—Л, –∞–Ј–Є–∞—В—Л –Є, —А–µ–ґ–µ, –Ї–Є—В–∞–є—Ж—Л –•–∞–љ—М.
FERMT3
–У–µ–љ FERMT3 (—З–ї–µ–љ —Б–µ–Љ–µ–є—Б—В–≤–∞ —Д–µ—А–Љ–Є—В–Є–љ–∞ 3) –Ї–Њ–і–Є—А—Г–µ—В –Ї–Є–љ–і–ї–Є–љ-3, —З–ї–µ–љ —Б–µ–Љ–µ–є—Б—В–≤–∞ –Ї–Є–љ–і–ї–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –≤–Ї–ї—О—З–∞–µ—В 3 —А–∞–Ј–ї–Є—З–љ—Л—Е –±–µ–ї–Ї–∞ —Д–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В–∞–Ї—В–∞, –Ј–∞–і–µ–є—Б—В–≤–Њ–≤–∞–љ–љ—Л—Е –≤ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–љ—В–µ–≥—А–Є–љ–∞. –≠—В–Њ –њ—А–Њ—Ж–µ—Б—Б, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –і–ї—П –Ї–ї–µ—В–Њ—З–љ—Л—Е –∞–і–≥–µ–Ј–Є–Є (—Б–ї–Є–њ–∞–љ–Є—П), —А–∞—Б–њ–ї–∞—Б—В—Л–≤–∞–љ–Є—П –Є¬† –Љ–Є–≥—А–∞—Ж–Є–Є, –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞, –∞ —В–∞–Ї–ґ–µ –≤—Л–ґ–Є–≤–∞–љ–Є—П, –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї. –Ъ–Є–љ–і–ї–Є–љ-3 вАУ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–є –±–µ–ї–Њ–Ї, —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –∞–Ї—В–Є–љ–Њ–≤—Л–Љ —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–Њ–Љ. –Ю–љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ–Љ –Ї–ї–∞—Б—Б–Њ–≤ –Є–љ—В–µ–≥—А–Є–љ–Њ–≤ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Є—Е –∞–і–≥–µ–Ј–Є–≤–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Є —Б–Є–≥–љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–Ј–љ—Г—В—А–Є –љ–∞—А—Г–ґ—Г, –Ї–Њ—В–Њ—А–∞—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –і–ї—П —А–µ–Ј–Њ—А–±—В–Є–≤–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–µ—Д–Є—Ж–Є—В –Ї–Є–љ–і–ї–Є–љ–∞-3 –≤—Л–Ј—Л–≤–∞–µ—В —В—П–ґ–µ–ї—Г—О –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –∞–ї—М—В–µ—А–∞—Ж–Є—О –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –Є –љ–∞—А—Г—И–∞–µ—В –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –њ—А–Є–ї–Є–њ–∞—В—М –Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є. –Ш–љ—В–µ—А–µ—Б–µ–љ —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ FERMT3 –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ —А–µ–і–Ї–Њ–µ –∞—Г—В–Њ—Б–Њ–Љ–љ–Њ-—А–µ—Ж–µ—Б—Б–Є–≤–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ–Њ–і –љ–∞–Ј–≤–∞–љ–Є–µ–Љ –і–µ—Д–Є—Ж–Є—В –∞–і–≥–µ–Ј–Є–Є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ (LAD-III), –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б LAD-III —В–∞–Ї–ґ–µ —Б—В—А–∞–і–∞—О—В –Њ—В —В—П–ґ–µ–ї–Њ–є —Д–Њ—А–Љ—Л –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ (10 –Є–Ј 23 –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е —Б–ї—Г—З–∞—П). –≠—В–Є –Љ—Г—В–∞—Ж–Є–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Љ–∞—Б—Б–µ —П–≤–ї—П—О—В—Б—П –≤—Л—Б–Њ–Ї–Њ —А–∞–Ј—А—Г—И–Є—В–µ–ї—М–љ—Л–Љ–Є: –Љ—Г—В–∞—Ж–Є–Є —Г—Б–µ—З–µ–љ–Є—П, –і–µ—Д–µ–Ї—В—Л —Б–њ–ї–∞–є—Б–Є–љ–≥–∞, —Б–і–≤–Є–≥ —А–∞–Љ–Ї–Є; –Є–Ј –≤—Б–µ–є –Ї–Њ–≥–Њ—А—В—Л –≤—Л—П–≤–ї–µ–љ—Л —В–Њ–ї—М–Ї–Њ 2 –Љ–Є—Б—Б–µ–љ—Б-–Љ—Г—В–∞—Ж–Є–Є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —З–Є—Б–ї–Њ –Њ–њ–Є—Б–∞–љ–љ—Л—Е –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ —Б–ї—Г—З–∞–µ–≤ –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–µ—Б—В–Є –Ї–Њ—А—А–µ–ї—П—Ж–Є—О –≥–µ–љ–Њ—В–Є–њ/—Д–µ–љ–Њ—В–Є–њ.
RANKL
–У–µ–љ RANKL (–ї–Є–≥–∞–љ–і —А–µ—Ж–µ–њ—В–Њ—А–∞-–∞–Ї—В–Є–≤–∞—В–Њ—А–∞ —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –Ї–∞–њ–њ–∞-B) –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ –і–ї—П —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≥–µ–љ–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ—Г—В–µ–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б –µ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ RANK –Ј–∞–њ—Г—Б–Ї–∞—О—В –∞–Ї—В–Є–≤–∞—Ж–Є—О –љ–Є—Б—Е–Њ–і—П—Й–µ–≥–Њ —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞, –≤—Л–Ј—Л–≤–∞—О—Й–µ–≥–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—О –Є –∞–Ї—В–Є–≤–∞—Ж–Є—О –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤.
–Э–µ–і–∞–≤–љ–Њ –±—Л–ї –љ–∞–є–і–µ–љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є —А–µ—Ж–µ–њ—В–Њ—А –Љ–Њ–ї–µ–Ї—Г–ї—Л RANKL, –±–Њ–≥–∞—В—Л–є –ї–µ–є—Ж–Є–љ–Њ–Љ –њ–Њ–≤—В–Њ—А-—Б–Њ–і–µ—А–ґ–∞—Й–Є–є G-–±–µ–ї–Њ–Ї-—Б–≤—П–Ј–∞–љ–љ—Л–є —А–µ—Ж–µ–њ—В–Њ—А 4 (LGR4), –Ї–Њ—В–Њ—А—Л–є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –ї–Є–≥–∞–љ–і–Њ–≤ –∞–Ї—В–Є–≤–Є—А—Г–µ—В —Б–Є–≥–љ–∞–ї—М–љ—Л–є –њ—Г—В—М GSK3, —В–µ–Љ —Б–∞–Љ—Л–Љ –њ–Њ–і–∞–≤–ї—П—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—О NFATc1 –≤ —Е–Њ–і–µ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≥–µ–љ–µ–Ј–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±—Л–ї–Є –Њ—В–Ї—А—Л—В—Л —А–∞–љ–µ–µ –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л–µ –Є –љ–µ–Њ–ґ–Є–і–∞–љ–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є RANKL –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –Є–≥—А–∞—О—Й–Є–µ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Њ—Б—В–µ–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Љ–µ–Ј–µ–љ—Е–Є–Љ–∞–ї—М–љ—Л—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б –њ–Њ–Љ–Њ—Й—М—О –∞—Г—В–Њ–Ї—А–Є–љ–љ–Њ–є –њ–µ—В–ї–Є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —Б–≤–µ–і–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –±–Њ–ї—М—И–Њ–є –Є–љ—В–µ—А–µ—Б –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ RANKL - ¬†—А–µ–і–Ї–Њ–є —Д–Њ—А–Љ—Л –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞, –Ї–Њ—В–Њ—А–∞—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤—Б–µ–≥–Њ 2 % –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤. –Ф–ї—П –ї—Г—З—И–µ–≥–Њ –њ–Њ–љ–Є–Љ–∞–љ–Є—П —Г–њ–Њ–Љ—П–љ—Г—В—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Є –Є—Е –Ј–љ–∞—З–µ–љ–Є—П –≤ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є –Ї–Њ—Б—В–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Я–Њ –Є–Љ–µ—О—Й–Є–Љ—Б—П –і–∞–љ–љ—Л–Љ, –љ–Њ–≤—Л—Е –Љ—Г—В–∞—Ж–Є–є –≥–µ–љ–∞ RANKL –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–Њ–Љ–Є–Љ–Њ —Г–ґ–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е, –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ.
RANK
–Ъ–∞–Ї —Г–ґ–µ —Г–њ–Њ–Љ–Є–љ–∞–ї–Њ—Б—М –≤—Л—И–µ, –≥–µ–љ RANK (—А–µ—Ж–µ–њ—В–Њ—А-–∞–Ї—В–Є–≤–∞—В–Њ—А —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –Ї–∞–њ–њ–∞-B) —П–≤–ї—П–µ—В—Б—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ –і–ї—П RANKL.–°–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б –ї–Є–≥–∞–љ–і–Њ–Љ¬† –≤—Л–Ј—Л–≤–∞–µ—В —В—А–Є–Љ–µ—А–Є–Ј–∞—Ж–Є—О —А–µ—Ж–µ–њ—В–Њ—А–∞ –Є —А–µ–Ї—А—Г—В–Є–љ–≥ —А–∞–Ј–ї–Є—З–љ—Л—Е –∞–і–∞–њ—В–Њ—А–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї, –∞ —В–∞–Ї–ґ–µ –∞–Ї—В–Є–≤–∞—Ж–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Є–≥–љ–∞–ї—М–љ—Л—Е –њ—Г—В–µ–є, —В–∞–Ї–Є—Е –Ї–∞–Ї c-Jun N-—В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–є –Ї–Є–љ–∞–Ј—Л (JNK)/–±–µ–ї–Њ–Ї-–∞–Ї—В–Є–≤–∞—В–Њ—А-1 (AP-1), —П–і–µ—А–љ—Л–є —Д–∞–Ї—В–Њ—А –Ї–∞–њ–њ–∞-B (NF-kB) –Є —П–і–µ—А–љ—Л–є —Д–∞–Ї—В–Њ—А –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ґ-–Ї–ї–µ—В–Њ–Ї —Б1 (NF-kB), Src –Є p38/MITF, Src and ERK, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—П, –∞–Ї—В–Є–≤–∞—Ж–Є—П –Є –≤—Л–ґ–Є–≤–∞–љ–Є–µ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤. –Ь—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ RANK¬† –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –Ј–∞ 5% —Б–ї—Г—З–∞–µ–≤ –Р–†–Ю. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ RANKL, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Ї–Њ—Б—В–љ—Л–µ –і–µ—Д–µ–Ї—В—Л –љ–µ –ї–µ—З–∞—В—Б—П –Ґ–У–°–Ъ, –њ—А–Є –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ RANK –Ґ–У–°–Ъ —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–µ–і–∞–≤–љ–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ.
SLC29A3
–Ф–Є—Б–Њ—Б—В–µ–Њ—Б–Ї–ї–µ—А–Њ–Ј вАУ —Н—В–Њ —А–µ–і–Ї–∞—П —Д–Њ—А–Љ–∞ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞, –Ї–Њ—В–Њ—А–∞—П —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤ –Љ–ї–∞–і–µ–љ—З–µ—Б—В–≤–µ –Є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —В–Є–њ–Є—З–љ—Л–Љ–Є —Б–Ї–µ–ї–µ—В–љ—Л–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є: (—А–∞—Б—И–Є—А–µ–љ–Є–µ –Ї–Њ–љ—Ж–Њ–≤ —В—А—Г–±—З–∞—В—Л—Е –Ї–Њ—Б—В–µ–є –Є –њ–ї–∞—В–Є—Б–њ–Њ–љ–і–Є–ї–Є—П), –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П–Љ–Є –Ї–Њ–ґ–Є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Є –њ—А–Њ–≥–љ–Њ–Ј—Л, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –і–Њ–≤–Њ–ї—М–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ. –Ш–Љ–µ—О—Й–Є–µ—Б—П –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–µ –і–∞–љ–љ—Л–µ –Ї–∞—Б–∞—В–µ–ї—М–љ–Њ –≥–µ–љ–µ—В–Є–Ї–Є –і–Є–Њ—Б—В–µ–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –і–Њ–≤–Њ–ї—М–љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ—Л. –У–µ–љ SLC29A3 (–≥–ї—О–Ї–Њ–Ј–љ—Л–є —В—А–∞—Б–њ–Њ—А—В–µ—А-3 —Б–µ–Љ–µ–є—Б—В–≤–∞ 29), –Ї–Њ—В–Њ—А—Л–є –њ—А–Є –і–Є—Б–Њ—Б—В–µ–Њ—Б–Ї–ї–µ—А–Њ–Ј–µ –њ–Њ—А–∞–ґ–µ–љ, –Ї–Њ–і–Є—А—Г–µ—В –љ—Г–Ї–ї–µ–Њ—В–Є–і–љ—Л–є —В—А–∞–љ—Б–њ–Њ—А—В–µ—А –ї–Є–Ј–Њ—Б–Њ–Љ, –≤ –±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ–Љ—Л–є –≤ –Ї–ї–µ—В–Ї–∞—Е –Љ–Є–µ–ї–Њ–Є–і–љ–Њ–є –ї–Є–љ–Є–Є. –Ю–њ–Є—Б—Л–≤–∞–µ–Љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є (NM_018344:c. 607T>C:p.Ser203Pro –Є c.1157G>A:p.Arg386Gln —Г –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Є c.1346C>G:p.Thr449Arg —Г –≤—В–Њ—А–Њ–≥–Њ –≤ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, –∞ —В–∞–Ї–ґ–µ c.303_320dup:p.102_107dup –≤ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є) –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –≤–ї–Є—П–љ–Є–µ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—О –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤, –љ–∞ —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В —Б–љ–Є–ґ–µ–љ–љ–Њ–µ —З–Є—Б–ї–Њ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –њ–Њ—Б–ї–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є
in vitro –Ь–Ъ–Я–Ъ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Њ–±—А–∞–Ј—Ж–Њ–≤ –±–Є–Њ–њ—Б–Є–Є –Ї–Њ—Б—В–Є. –Ь—Г—В–∞—Ж–Є–Є SLC29A3 —В–∞–Ї–ґ–µ –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П¬† —Б –≥–Є—Б—В–Є–Њ—Ж–Є—В–Њ–Ј–Њ–Љ —Б –Љ–∞—Б—Б–Є–≤–љ–Њ–є –ї–Є–Љ—Д–∞–і–µ–љ–Њ–њ–∞—В–Є–µ–є вАУ –≥—А—Г–њ–њ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –љ–µ –Ј–∞—В—А–∞–≥–Є–≤–∞—О—Й–Є—Е –Є–ї–Є –ї–Є—И—М —Б–ї–µ–≥–Ї–∞ –Ј–∞—В—А–∞–≥–Є–≤–∞—О—Й–Є—Е —Б–Ї–µ–ї–µ—В. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–ї—П –ї—Г—З—И–µ–≥–Њ –њ–Њ–љ–Є–Љ–∞–љ–Є—П —А–Њ–ї–Є –і–∞–љ–љ–Њ–≥–Њ –≥–µ–љ–∞ –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –Є –Њ—Б–Њ–±–µ–љ–љ–Њ вАУ –≤ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є –≤ —Ж–µ–ї–Њ–Љ.
CTSK
–Я–Є–Ї–љ–Њ–і–Є–Ј–Њ—Б—В–Њ–Ј - —Н—В–Њ —А–µ–і–Ї–∞—П –∞—Г—В–Њ—Б–Њ–Љ–љ–Њ-—А–µ—Ж–µ—Б—Б–Є–≤–љ–∞—П —Б–Ї–µ–ї–µ—В–љ–∞—П –і–Є—Б–њ–ї–∞–Ј–Є—П (–њ—А–Є–Љ–µ—А–љ–∞—П —З–∞—Б—В–Њ—В–∞ —Б–ї—Г—З–∞–µ–≤ - 1:1,7 –Љ–ї–љ. —З–µ–ї–Њ–≤–µ–Ї), –Ї–Њ—В–Њ—А—Г—О –≤–Ї–ї—О—З–∞—О—В –≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ –Є–Ј-–Ј–∞ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –≤ —В—А—Г–±—З–∞—В—Л—Е –Ї–Њ—Б—В—П—Е. –Ф—А—Г–≥–Є–µ —В–Є–њ–Є—З–љ—Л–µ –і–ї—П –њ–Є–Ї–љ–Њ–і–Є–Ј–Њ—Б—В–Њ–Ј–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –≤–Ї–ї—О—З–∞—О—В –љ–Є–Ј–Ї–Њ—А–Њ—Б–ї–Њ—Б—В—М, –Ї–Њ—В–Њ—А—Г—О —Б –њ–µ—А–µ–Љ–µ–љ–љ—Л–Љ —Г—Б–њ–µ—Е–Њ–Љ –Љ–Њ–ґ–љ–Њ –ї–µ—З–Є—В—М –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є —А–Њ—Б—В–∞, –љ–µ–Ј–∞–Ї—А—Л—В—Л–µ —А–Њ–і–љ–Є—З–Њ–Ї –Є —И–≤—Л —З–µ—А–µ–њ–∞, –њ–µ—А–µ–ї–Њ–Љ—Л, —В—Г–њ–Њ–є –љ–Є–ґ–љ–µ—З–µ–ї—О—Б—В–љ–Њ–є —Г–≥–Њ–ї –Є –∞–Ї—А–Њ–Њ—Б—В–µ–Њ–ї–Є–Ј –і–Є—Б—В–∞–ї—М–љ–Њ–є —Д–∞–ї–∞–љ–≥–Є. –Я—А–Є –і–∞–љ–љ–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є –њ–Њ—А–∞–ґ–µ–љ –≥–µ–љ CTSK, –Ї–Њ–і–Є—А—Г—О—Й–Є–є –Ї–∞—В–µ–њ—Б–Є–љ –Ъ вАУ —Ж–Є—Б—В–µ–Є–љ–Њ–≤—Г—О –њ–µ–њ—В–Є–і–∞–Ј—Г —Б—Г–њ–µ—А—Б–µ–Љ–µ–є—Б—В–≤–∞ –њ–∞–њ–∞–Є–љ, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Г—О –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–∞–Љ–Є –і–ї—П –і–µ–≥—А–∞–і–∞—Ж–Є–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Є –Њ–±–ї–∞–і–∞—О—Й—Г—О —Г–љ–Є–Ї–∞–ї—М–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —А–∞—Б—Й–µ–њ–ї—П—В—М –Љ–Њ–ї–µ–Ї—Г–ї—Л –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ –љ–∞ –Љ–∞–ї–µ–љ—М–Ї–Є–µ —Д—А–∞–≥–Љ–µ–љ—В—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–і–∞–≤–љ–Њ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –Ї–∞—В–µ–њ—Б–Є–љ –Ъ —А–∞—Б—Й–µ–њ–ї—П–µ—В –Є –∞–Ї—В–Є–≤–Є—А—Г–µ—В –Љ–∞—В—А–Є–Ї—Б–љ—Г—О –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј—Г 9
in vitro, —З—В–Њ –Љ–Њ–ґ–µ—В —Г–Ї–∞–Ј—Л–≤–∞—В—М –љ–∞ –љ–∞–ї–Є—З–Є–µ –њ—А–Њ—В–µ–∞–Ј-—Б–Є–≥–љ–∞–ї—М–љ–Њ–є —Б–µ—В–Є, –≤–µ—А–Њ—П—В–љ–Њ —А–µ–ї–µ–≤–∞–љ—В–љ–Њ–є –і–ї—П —А—П–і–∞ —Д–Є–Ј–Є–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є. –Ґ–∞–Ї–ґ–µ –њ–Њ—Б–ї–µ–і–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Ї–∞—В–µ–њ—Б–Є–љ-K –Є–≥—А–∞–µ—В —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—Б—В–Є –њ—Г—В–µ–Љ –і–µ–≥—А–∞–і–∞—Ж–Є–Є –њ–µ—А–Є–Њ—Б—В–Є–љ–∞ - –±–µ–ї–Ї–∞ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Ї–Њ—А—В–Є–Ї–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞–і–Ї–Њ—Б—В–љ–Є—Ж—Л –њ—А–Є —Г—З–∞—Б—В–Є–Є —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –њ—Г—В–Є Wnt-ќ≤-–Ї–∞—В–µ–љ–Є–љ–∞.
–Ф–Њ —Б–Є—Е –њ–Њ—А –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –±—Л–ї–Њ –Њ–њ–Є—Б–∞–љ–Њ –Њ–Ї–Њ–ї–Њ 60 —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є CTSK —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–µ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е —А–µ–≥–Є–Њ–љ–Њ–≤. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –Љ–Є—Б—Б–µ–љ—Б-–Љ—Г—В–∞—Ж–Є–Є, —В–∞–Ї–ґ–µ –≤—Л—П–≤–ї–µ–љ—Л —Б–і–≤–Є–≥ —А–∞–Љ–Ї–Є, –љ–Њ–љ—Б–µ–љ—Б-–Љ—Г—В–∞—Ж–Є–Є –Є –і–µ—Д–µ–Ї—В—Л —Б–њ–ї–∞–є—Б–Є–љ–≥–∞. –Ь—Г—В–∞—Ж–Є–Є –≤–Њ–Ј–љ–Є–Ї–∞—О—В, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ, –≤ –Ј—А–µ–ї—Л—Е CTSK-–±–µ–ї–Ї–∞—Е, —Б ¬Ђ–≥–Њ—А—П—З–Є–Љ–Є —В–Њ—З–Ї–∞–Љ–Є¬ї –≤ 5 –Є 6 —Н–Ї–Ј–Њ–љ–∞—Е.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–Ї–Њ–ї–Њ 6% –Љ—Г—В–∞—Ж–Є–є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –≤ –њ—А–µ—А–µ–≥–Є–Њ–љ–µ –Є 25 % - –≤ –њ—А–Њ—А–µ–≥–Є–Њ–љ–µ вАУ –љ–µ–±–Њ–ї—М—И–Є—Е N-—В–µ—А–Љ–Є–љ–∞–ї—М–љ—Л—Е –і–Њ–Љ–µ–љ–∞—Е, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –і–ї—П –њ—А–∞–≤–Є–ї—М–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є —Г–Ї–ї–∞–і–Ї–Є –±–µ–ї–Ї–Њ–≤ –Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞. –Я—А–Њ—А–µ–≥–Є–Њ–љ —В–∞–Ї–ґ–µ –≤–∞–ґ–µ–љ –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —Д–µ—А–Љ–µ–љ—В–Њ–≤ –≤ –љ–µ–∞–Ї—В–Є–≤–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, –њ—А–Є –љ–Є–Ј–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ pH –Њ–љ —А–∞—Б—Й–µ–њ–ї–µ–љ. –Я—А–Є —Н—В–Њ–Љ –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –≥–µ–љ–Њ—В–Є–њ-—Д–µ–љ–Њ—В–Є–њ –і–Њ —Б–Є—Е –њ–Њ—А –Њ—Б—В–∞–µ—В—Б—П –љ–µ–Є–Ј—Г—З–µ–љ–љ–Њ–є –і–Њ –Ї–Њ–љ—Ж–∞.
–У–µ–љ—Л, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л–µ –≤ –љ–µ–і–∞–≤–љ–Њ –Њ—В–Ї—А—Л—В—Л–µ —Б–Є–љ–і—А–Њ–Љ–љ—Л–µ —Д–Њ—А–Љ—Л –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞
TRAF6
–Э–∞—А—П–і—Г —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –∞–і–∞–њ—В–Њ—А–љ—Л–Љ–Є –Љ–Њ–ї–µ–Ї—Г–ї–∞–Љ–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ–Є –і–ї—П —Б–≤—П–Ј—Л–≤–∞–љ–Є—П ¬†RANKL/ RANK, TRAF6 (TNF-—А–µ—Ж–µ–њ—В–Њ—А-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є-—Д–∞–Ї—В–Њ—А-6) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ–Њ–є. –Ф–µ–є—Б—В–≤–Є–µ TRAF6 —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–∞–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ґ- –Є B-–Ї–ї–µ—В–Њ–Ї, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –∞–Ї—В–Є–≤–∞—Ж–Є–Є NF-kB. –Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В –љ–∞–Ј–∞–і –±—Л–ї–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ, —З—В–Њ –і–µ–∞–Ї—В–Є–≤–∞—Ж–Є—П –≥–µ–љ–∞ TRAF6 —Г –Љ—Л—И–µ–є –≤—Л–Ј—Л–≤–∞–µ—В —В—П–ґ–µ–ї—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј, –Є, –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ, —Б—Е–Њ–ґ–µ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –Є —Г —З–µ–ї–Њ–≤–µ–Ї–∞. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–∞—П –і–µ–ї–µ—Ж–Є—П 2064 Kb –≤ 11-–Њ–є —Е—А–Њ–Љ–Њ—Б–Њ–Љ–µ, –њ–µ—А–µ–Ї—А—Л–≤–∞—О—Й–∞—П 5 —А–µ–≥–Є–Њ–љ –≤ –≥–µ–љ–∞—Е TRAF6, RAG1 –Є RAG2 (–±–µ–ї–Ї–Є RAG –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П —А–µ–Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ B –Є T –Ї–ї–µ—В–Њ–Ї, –∞ —В–∞–Ї–ґ–µ –і–ї—П –Є—Е –≤—Л–ґ–Є–≤–∞–љ–Є—П –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є) –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ —Г 2 —Б–Є–±–ї–Є–љ–≥–Њ–≤ —Б –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ –Є —В—П–ґ–µ–ї—Л–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–Њ–Љ (–Ґ–Ъ–Ш–Ф) —Б –њ–Њ–Љ–Њ—Й—М—О —Е—А–Њ–Љ–Њ—Б–Њ–Љ–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ–Љ–∞—В—А–Є—З–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –Ґ–Њ—З–љ—Л–µ –≥—А–∞–љ–Є—Ж—Л –і–µ–ї–µ—Ж–Є–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –љ–µ –±—Л–ї–Є; —З—В–Њ –ґ–µ –Ї–∞—Б–∞–µ—В—Б—П TRAF6, –µ–≥–Њ –≥–µ–љ–Њ–Љ–љ–∞—П –і–µ–ї–µ—Ж–Є—П –≤–Ї–ї—О—З–∞–ї–∞ —А–µ–≥–Є–Њ–љ –≤—Л—И–µ 1 —Н–Ї–Ј–Њ–љ–∞ –Є —З–∞—Б—В—М –љ–µ–Ї–Њ–і–Є—А—Г—О—Й–µ–є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є —Н–Ї–Ј–Њ–љ–∞ 1. –Ф–∞–љ–љ—Л–µ —Г—З–∞—Б—В–Ї–Є —Б –±–Њ–ї—М—И–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О —П–≤–ї—П—О—В—Б—П —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л–Љ–Є. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, –љ–∞ –±–µ–ї–Ї–Њ–≤–Њ–Љ —Г—А–Њ–≤–љ–µ –Є—Е –і–µ–ї–µ—Ж–Є—П¬† –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ—П–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О TRAF6. –†–µ–Ј—Г–ї—М—В–Є—А—Г—О—Й–Є–є —Д–µ–љ–Њ—В–Є–њ —П–≤–ї—П–µ—В—Б—П —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ–Њ–є –Љ—Г—В–∞—Ж–Є–є –±—Л–ї –≤—Л—А–∞–ґ–µ–љ –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –≤ –Ї–Њ—Б—В—П—Е —В–∞–Ј–∞ –Є –љ–Њ–≥. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –Њ–±–Њ–Є—Е —Б–ї—Г—З–∞—П—Е –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і –љ–∞—Б—В—Г–њ–Є–ї –≤ –Њ—З–µ–љ—М —А–∞–љ–љ–µ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –≤ —Б–≤—П–Ј–Є —Б —В—П–ґ–µ–ї—Л–Љ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–Њ–Љ –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ–і–Њ–±–љ—Л–µ —Б–ї—Г—З–∞–Є –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л, –њ—А–Њ—Б–ї–µ–і–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ —Б–Ї–µ–ї–µ—В–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –і–∞–љ–љ–Њ–є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –±–∞–Ј–Њ–є –Ј–∞—В—А—Г–і–љ–Є—В–µ–ї—М–љ–Њ.
LRRK1
–Ю—Б—В–µ–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–љ–∞—П –Љ–µ—В–∞—Д–Є–Ј–∞—А–љ–∞—П –і–Є—Б–њ–ї–∞–Ј–Є—П —П–≤–ї—П–µ—В—Б—П —Д–Њ—А–Љ–Њ–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞, –њ–Њ—А–∞–ґ–∞—О—Й–µ–є –Љ–µ—В–∞—Д–Є–Ј –і–ї–Є–љ–љ—Л—Е –Ї–Њ—Б—В–µ–є, –Ї–Њ–љ—Ж–µ–≤—Л–µ –њ–ї–∞—Б—В–Є–љ–Ї–Є –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –Њ–Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є —А–µ–±–µ—А, –∞ —В–∞–Ї–ґ–µ –Ї—А–∞—П –њ–ї–Њ—Б–Ї–Є—Е –Ї–Њ—Б—В–µ–є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —З–µ—А–µ–њ –Њ—Б—В–∞–µ—В—Б—П –љ–µ–њ–Њ—А–∞–ґ–µ–љ–љ—Л–Љ. –Ю–њ–Є—Б–∞–љ–Њ —В–Њ–ї—М–Ї–Њ 5 —Б–ї—Г—З–∞–µ–≤ –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П; –≤ –Њ–і–љ–Њ–Љ –Є–Ј –љ–Є—Е –љ–µ–і–∞–≤–љ–Њ –±—Л–ї–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–∞—П –і–µ–ї–µ—Ж–Є—П —Б–µ–Љ–Є –љ—Г–Ї–ї–µ–Њ—В–Є–і–Њ–≤ –≤ –њ–Њ—Б–ї–µ–і–љ–µ–Љ —Н–Ї–Ј–Њ–љ–µ –≥–µ–љ–∞ LRRK1 (–ї–µ–є—Ж–Є–љ-–±–Њ–≥–∞—В–∞—П –њ–Њ–≤—В–Њ—А–љ–∞—П –Ї–Є–љ–∞–Ј–∞ 1) (NM_024652:c.5938_5944delGAGTGGT:p.Glu1980Alafs*66), –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤—Л–Ј–≤–∞–≤—И–∞—П —Б–і–≤–Є–≥ —А–∞–Љ–Ї–Є –Є –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Г—О —В–µ—А–Љ–Є–љ–∞—Ж–Є—О, —Б –њ–Њ—В–µ—А–µ–є —Б–µ–і—М–Љ–Њ–є —В—А–Є–њ—В–Њ—Д–∞–љ-–∞—Б–њ–∞—А—В–Є—З–µ—Б–Ї–Њ–є –Ї–Є—Б–ї–Њ—В—Л (WD) 40-–≥–Њ –і–Њ–Љ–µ–љ–∞. –Ф–Њ–Љ–µ–љ WD-40, —В–∞–Ї–ґ–µ –Ї–∞–Ї –Њ—Б—В–∞–ї—М–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –і–Њ–Љ–µ–љ—Л –±–µ–ї–Ї–∞ LRRK1, –≤—Л—Б—В—Г–њ–∞–µ—В –њ–Њ—Б—А–µ–і–љ–Є–Ї–Њ–Љ –≤–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є –±–µ–ї–Њ–Ї-–±–µ–ї–Њ–Ї. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, LRRK1 –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –њ—Г—В–Є c-Src –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–љ–Њ–є –њ–µ—А–µ—Б—В—А–Њ–є–Ї–Є –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Д–µ—Б—В–Њ–љ—З–∞—В–Њ–≥–Њ –Ї—А–∞—П –Є –њ–Њ–і–Њ—Б–Њ–Љ—Л. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г –Љ—Л—И–µ–є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В—Л —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ Lrrk1 —П–≤–ї—П—О—В—Б—П –Ї—А—Г–њ–љ—Л–Љ–Є –Є –њ–ї–Њ—Б–Ї–Є–Љ–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ–љ–Є –љ–µ—Б–њ–Њ—Б–Њ–±–љ—Л –і–Њ–ї–ґ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Њ—Б—Г—Й–µ—Б—В–≤–Є—В—М —А–µ–Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—О —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–∞ –Є —А–µ–Ј–Њ—А–±—Ж–Є—О –Ї–Њ—Б—В–Є. –У–µ–љ LRRK1, –≤ —Ж–µ–ї–Њ–Љ, –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –≤—Л—Б–Њ–Ї–Є–є –Є–љ—В–µ—А–µ—Б –і–ї—П –Ї–Њ—Б—В–љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є–Є –Є –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–Њ–ї–ґ–љ—Л –Њ–њ—А–µ–і–µ–ї–Є—В—М –µ–≥–Њ —Д–Є–Ј–Є–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —А–Њ–ї—М.
MITF
–Ь–Є–Ї—А–Њ—Д—В–∞–ї—М–Љ–Є—П-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ—Л–є —Д–∞–Ї—В–Њ—А (MITF) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ—Л–є —Д–∞–Ї—В–Њ—А —Б –Њ—Б–љ–Њ–≤–љ—Л–Љ –і–Њ–Љ–µ–љ–Њ–Љ —В–Є–њ–∞ —Б–њ–Є—А–∞–ї—М-–њ–µ—В–ї—П-—Б–њ–Є—А–∞–ї—М (–ї–µ–є—Ж–Є–љ–Њ–≤–∞—П –Ј–∞—Б—В–µ–ґ–Ї–∞). –Ю–љ —Д–Њ—А–Љ–Є—А—Г–µ—В –≥–Њ–Љ–Њ- –Є –≥–µ—В–µ—А–Њ–і–Є–Љ–µ—А—Л, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–µ –≥–µ–љ–љ—Г—О —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Ї–∞–љ—П—Е. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ –µ–≥–Њ –Љ—Г—В–∞—Ж–Є—П –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М —И–Є—А–Њ–Ї–Є–є —Б–њ–µ–Ї—В—А —Д–µ–љ–Њ—В–Є–њ–Њ–≤. –Т –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є MITF –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –і–µ–є—Б—В–≤—Г–µ—В —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б —Б–Є–≥–љ–∞–ї—М–љ—Л–Љ –њ—Г—В–µ–Љ RANKL/RANK, —Г–Љ–µ–љ—М—И–∞—П –њ—А–Њ–і—Г–Ї—Ж–Є—О NFATc1 –і–ї—П —Г—Б–Є–ї–µ–љ–Є—П NFATc1-–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≥–µ–љ–љ–Њ–≥–Њ —Б–Є–≥–љ–∞–ї–∞. –Ш –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –і–ї—П –Љ—Л—И–µ–є —Б Mitf
mi/mi —Е–∞—А–∞–Ї—В–µ—А–µ–љ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј –≤ —Б–≤—П–Ј–Є —Б –і–µ—Д–µ–Ї—В–Њ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≥–µ–љ–µ–Ј–∞ –љ–∞ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е.
–°–ї–Њ–ґ–љ—Л–µ –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ MITF —Б–Њ–≤—Б–µ–Љ –љ–µ–і–∞–≤–љ–Њ –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г –і–≤—Г—Е –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В.–љ. COMMAD-—Б–Є–љ–і—А–Њ–Љ–Њ–Љ (–Ї–Њ–ї–Њ–±–Њ–Љ–∞, –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј, –Љ–Є–Ї—А–Њ—Д—В–∞–ї—М–Љ–Є—П, –Љ–∞–Ї—А–Њ—Ж–µ—Д–∞–ї–Є—П, –∞–ї—М–±–Є–љ–Є–Ј–Љ –Є –≥–ї—Г—Е–Њ—В–∞). –Т—Л—П–≤–ї–µ–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є (NM_198159.2:c.952_ 954delAGA:p.Arg318del and c.921G>C:p.Lys307Asn —Г –њ—А–Њ–±–∞–љ–і–∞ I; c.952A>G:p.Arg318Gly –Є c.938- 1G>A:p.Leu312fs ¬†—Г –њ—А–Њ–±–∞–љ–і–∞ II) –њ–Њ–≤–ї–Є—П–ї–Є –љ–µ –љ–∞ –і–Є–Љ–µ—А–Є–Ј–∞—Ж–Є—О MITF, –∞ —Б–Ї–Њ—А–µ–µ –љ–∞ –µ–≥–Њ –Љ–Є–≥—А–∞—Ж–Є—О –≤–љ—Г—В—А–Є —П–і—А–∞ –Є –Ф–Э–Ъ-—Б–≤—П–Ј—Л–≤–∞—О—Й–Є–µ —Б–≤–Њ–є—Б—В–≤–∞. –Ф–∞–љ–љ–Њ–µ –Њ—В–Ї—А—Л—В–Є–µ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —А—П–і —Д–µ–љ–Њ—В–Є–њ–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б MITF; —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≤–∞—А–Є–∞–љ—В–Њ–≤ —Б —А–µ—Ж–µ—Б—Б–Є–≤–љ—Л–Љ–Є –Љ—Г—В–∞—Ж–Є—П–Љ–Є, –і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ—Л —Б —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Т–∞–∞–љ–і–µ—А–±—Г—А–≥–∞ —В–Є–њ–∞ 2A –Є —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Ґ–Є—Ж–∞, –і–ї—П –Ї–Њ—В–Њ—А—Л—Е —Е–∞—А–∞–Ї—В–µ—А–љ—Л –≥–ї—Г—Е–Њ—В–∞ –Є –њ–Є–≥–Љ–µ–љ—В–љ—Л–є –і–µ—Д–Є—Ж–Є—В. –Т —Ж–µ–ї–Њ–Љ, —Н—В–Є –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М MITF –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е —А–∞–Ј–≤–Є—В–Є—П, –∞ —В–∞–Ї–ґ–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Є –≤—Л–ґ–Є–≤–∞–љ–Є—П –Ї–ї–µ—В–Њ–Ї.
–°–Є–≥–љ–∞–ї—М–љ—Л–є –њ—Г—В—М NF-kB
–°–Є–≥–љ–∞–ї—М–љ—Л–є –њ—Г—В—М NF-kB –≤–Ї–ї—О—З–∞–µ—В —А—П–і –Љ–Њ–ї–µ–Ї—Г–ї (–≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ, –Ї–Є–љ–∞–Ј—Л –Є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л), –Ї–Њ—В–Њ—А—Л–µ –Є–≥—А–∞—О—В –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е –≥–µ–љ–Њ–≤ –≤–Њ –Љ–љ–Њ–≥–Є—Е –Њ—А–≥–∞–љ–∞—Е –Є —Д–Є–Ј–Є–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е. –Т –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞ —Н—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –≥–Є–њ–Њ–Љ–Њ—А—Д–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ NEMO, –Ї–Њ–і–Є—А—Г—О—Й–µ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В IkB-–Ї–Є–љ–∞–Ј–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П IkB-ќ± –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —П–і–µ—А–љ–Њ–є —В—А–∞–љ—Б–ї–Њ–Ї–∞—Ж–Є–Є –њ—А–Њ–і—Г—Ж–Є—А—Г–µ–Љ–Њ–≥–Њ –≥–µ—В–µ—А–Њ–і–Є–Љ–µ—А–∞ p65/p50, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ –•-—Б—Ж–µ–њ–ї–µ–љ–љ—Л–є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј —Б —Н–Ї—В–Њ–і–µ—А–Љ–∞–ї—М–љ–Њ–є –і–Є—Б–њ–ї–∞–Ј–Є–µ–є –Є –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–Њ–Љ. –Ф–∞–љ–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ—Л –≤ –±–µ–ї–Ї–Њ–≤–Њ–Љ –і–Њ–Љ–µ–љ–µ ¬Ђ—Ж–Є–љ–Ї–Њ–≤—Л–є –њ–∞–ї–µ—Ж¬ї –Є –њ—А–Є–≤–Њ–і—П—В –Ї –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј—Г –њ–Њ –њ—А–Є—З–Є–љ–µ –∞–ї—М—В–µ—А–∞—Ж–Є–Є —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –њ—Г—В–Є RANKL/RANK.
–Э–µ–і–∞–≤–љ–Њ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –±–µ–ї–Њ–Ї p65 (Rela) —Б–∞–Љ –њ–Њ —Б–µ–±–µ —Б–≤—П–Ј–∞–љ —Б —Д–µ–љ–Њ—В–Є–њ–Њ–Љ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–Љ—Б—П –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б–Њ–є. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, –≤ —Б–ї—Г—З–∞–µ —Б –≤–љ–µ–Ј–∞–њ–љ—Л–Љ –ї–µ—В–∞–ї—М–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞, –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л, –≤—Л—П–≤–ї–µ–љ–љ–Њ–µ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –∞—Г—В–Њ–њ—Б–Є–Є –Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤, –Ї–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, –±—Л–ї–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–Њ —Б de novo –Љ–Є—Б—Б–µ–љ—Б-–Љ—Г—В–∞—Ж–Є–µ–є –≥–µ–љ–∞ RELA (NM_021975.3:c.1534_ 1535delinsAG:p.Asp512Ser). –Ф–∞–љ–љ–∞—П –Љ—Г—В–∞—Ж–Є—П, –њ–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П–Љ, –љ–∞—А—Г—И–∞–µ—В —Б–Є–≥–љ–∞–ї–Є–Ј–∞—Ж–Є—О NF-kB –≤ —Д–Є—А–Њ–±–ї–∞—Б—В–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—П–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є.
CSF1R
–Э–∞—А—П–і—Г —Б RANKL, M-CSF —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤–Њ–є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≥–µ–љ–љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї–Њ–є. –≠—В–Њ –Љ–Њ–ґ–љ–Њ —П–≤–љ–Њ –љ–∞–±–ї—О–і–∞—В—М –њ—А–Є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–µ —Б –љ–µ—Е–≤–∞—В–Ї–Њ–є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ —Г –Љ—Л—И–µ–є —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –і–∞–љ–љ–Њ–≥–Њ —Ж–Є—В–Њ–Ї–Є–љ–∞ (–Љ—Л—И–Є–љ–∞—П –Љ–Њ–і–µ–ї—М op/op). –£ –Љ—Л—И–µ–є –і–µ—Д–Є—Ж–Є—В M-CSF-—А–µ—Ж–µ–њ—В–Њ—А–∞ (CSF1R) –њ—А–Є–≤–Њ–і–Є—В –Ї —Б—Е–Њ–і–љ–Њ–Љ—Г –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–љ–Њ–Љ—Г —Д–µ–љ–Њ—В–Є–њ—Г; –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–±–µ –Љ–Њ–і–µ–ї–Є –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –і–µ—Д–µ–Ї—В—Л –≤—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞, —Д–µ—А—В–Є–ї—М–љ–Њ—Б—В–Є –Є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є.
–Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ —В–Њ, —З—В–Њ –і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ CSF1R –≤—Л–Ј—Л–≤–∞—О—В –≤–Ј—А–Њ—Б–ї—Г—О —Д–Њ—А–Љ—Г —Н–љ—Ж–µ—Д–∞–ї–Њ–Љ–Є–Њ–њ–∞—В–Є–Є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б–Њ–≤—Б–µ–Љ –љ–µ–і–∞–≤–љ–Њ –њ–Њ–і–Њ–Ј—А–µ–≤–∞–ї–Њ—Б—М, —З—В–Њ –Є–Љ–µ–љ–љ–Њ —А–µ—Ж–µ—Б—Б–Є–≤–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –і–∞–љ–љ–Њ–≥–Њ –≥–µ–љ–∞ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–∞ –Ј–∞ –ї–µ—В–∞–ї—М–љ—Л–є, —В—П–ґ–µ–ї—Л–є —Д–µ–љ–Њ—В–Є–њ —Г 2 —Б–Є–±–ї–Є–љ–≥–Њ–≤ —Б –≥–µ–љ–µ—А–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ –Є –Љ–∞–ї—М—Д–Њ—А–Љ–∞—Ж–Є–µ–є –Љ–Њ–Ј–≥–∞ –≤ —В—П–ґ–µ–ї–Њ–є —Д–Њ—А–Љ–µ.
–Т–Ї—А–∞—В—Ж–µ, —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Н–Ї–Ј–Њ–Љ–∞ –±–ї–Є–Ј–Ї–Њ—А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е —А–Њ–і–Є—В–µ–ї–µ–є –≤—Л—П–≤–Є–ї–Њ –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ—Г—О –Љ—Г—В–∞—Ж–Є—О —Г—Б–µ—З–µ–љ–Є—П (NM_001288705.1:c.1620C>T:p.Tyr540*) –≤ –≥–µ–љ–µ CSF1R, –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–ї –±–µ–ї–Њ–Ї —Б –љ–µ—Е–≤–∞—В–Ї–Њ–є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –і–Њ–Љ–µ–љ–∞, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –ї–Є–≥–∞–љ–і-–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –і–Є–Љ–µ—А–Є–Ј–∞—Ж–Є–Є –Є –∞—Г—В–Њ—Д–Њ—Б—Д–Њ—А–µ–ї—П—Ж–Є–Є. –Т —Г—Б–ї–Њ–≤–Є—П—Е –Њ—В—Б—Г—В—Б—В–≤–Є—П –Њ–±—А–∞–Ј—Ж–Њ–≤ –Ф–Э–Ъ, –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ—Б—В—М –Љ—Г—В–∞—Ж–Є–Є CSF1R —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –Љ–Њ–≥–ї–∞ –±—Л—В—М –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞; –њ–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ–ї—М–Ј—П —Б—З–Є—В–∞—В—М –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ–Є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –љ–∞ –Є—Е –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –≥–µ–љ—Л –і—А—Г–≥–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ —Б—Е–Њ–і–љ—Л–Љ —Д–µ–љ–Њ—В–Є–њ–Њ–Љ, —З—В–Њ–±—Л –њ–Њ–њ—Л—В–∞—В—М—Б—П –Њ–њ—А–µ–і–µ–ї–Є—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П.
C16orf57
–Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В –љ–∞–Ј–∞–і –±—Л–ї –Њ–њ–Є—Б–∞–љ —Б–ї—Г—З–∞–є –Є—В–∞–ї—М—П–љ—Б–Ї–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞, —Г –Ї–Њ—В–Њ—А–Њ–≥–Њ –±—Л–ї –Њ–±–љ–∞—А—Г–ґ–µ–љ –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є —Б –њ–Њ–є–Ї–Є–ї–Њ–і–µ—А–Љ–Є–µ–є –Є –љ–µ–є—В—А–Њ–њ–µ–љ–Є–µ–є (–Я–Э). –Я–Э-—Б–Є–љ–і—А–Њ–Љ - ¬†—Н—В–Њ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–є –≥–µ–љ–Њ–і–µ—А–Љ–∞—В–Њ–Ј, –Ї–Њ—В–Њ—А—Л–є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —А–∞–љ–љ–µ–є –њ–Њ–є–Ї–Є–ї–Њ–і–µ—А–Љ–Є–µ–є, –і–Є—Б—В—А–Њ—Д–Є–µ–є –љ–Њ–≥—В–µ–є, –ї–∞–і–Њ–љ–љ–Њ-–њ–Њ–і–Њ—И–≤–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–µ—А–∞—В–Њ–Ј–Њ–Љ –Є —Г—Б—В–Њ–є—З–Є–≤–Њ–є –љ–µ–є—В—А–Њ–њ–µ–љ–Є–µ–є, –њ—А–Є–≤–Њ–і—П—Й–µ–є –Ї —А–µ–Ї—Г—А—А–µ–љ—В–љ—Л–Љ –Є–љ—Д–µ–Ї—Ж–Є—П–Љ. –Т –њ–Њ–і–Њ–±–љ—Л—Е —Б–ї—Г—З–∞—П—Е –Љ–Њ–≥—Г—В –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞—В—М —Б–Ї–µ–ї–µ—В–љ—Л–µ –і–µ—Д–µ–Ї—В—Л, —В–∞–Ї–Є–µ, –Ї–∞–Ї –Њ—Б—В–µ–Њ–њ–µ–љ–Є—П, –Ї—А–∞–љ–Є–Њ—Д–∞—Ж–Є–∞–ї—М–љ—Л–є –і–Є—Б–Љ–Њ—А—Д–Є–Ј–Љ, –њ–µ—А–µ–ї–Њ–Љ—Л, –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ–∞—П –Ј–∞–і–µ—А–ґ–Ї–∞ —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –Є —А–Њ—Б—В–∞ —Б–Ї–µ–ї–µ—В–∞. –Ю–і–љ–∞–Ї–Њ —Б–ї—Г—З–∞–є, –Њ–њ–Є—Б–∞–љ–љ—Л–є –Ь–Є–ї—М—П—З—З–Њ —Б —Б–Њ–∞–≤—В. –Њ–Ї–∞–Ј–∞–ї—Б—П –љ–µ—В–Є–њ–Є—З–љ—Л–Љ. –Я–Э-—Б–Є–љ–і—А–Њ–Љ –±—Л–ї –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –Љ—Г—В–∞—Ж–Є—П–Љ–Є –≥–µ–љ–∞ C16orf57, –Ї–Њ–і–Є—А—Г—О—Й–µ–≥–Њ —Д–Њ—Б—Д–Њ–і–Є—Н—Б—В–µ—А–∞–Ј—Г, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Г—О –Ј–∞ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—О –Є —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—О U6 –љ–µ–±–Њ–ї—М—И–Њ–є —П–і–µ—А–љ–Њ–є –†–Э–Ъ (USB1), –Ї–Њ—В–Њ—А–∞—П —П–≤–ї—П–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ —Н–ї–µ–Љ–µ–љ—В–Њ–Љ —Б—В—А—Г–Ї—В—Г—А—Л —Б–њ–ї–∞–є—Б–Њ–Љ—Л.
–Я–Њ–Ј–і–љ–µ–µ —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Њ—Б—В–Њ–њ–µ—В—А–Њ–Ј–Њ–Љ –Є –Я–Э –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–∞—П —Б—В–Њ–њ-–Љ—Г—В–∞—Ж–Є—П –≤ –≥–µ–љ–µ C16orf57 (ENSG00000103005:c.232C>T:p.Arg78*), –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤—Л–Ј–≤–∞–≤—И–∞—П —Б–µ—А—М–µ–Ј–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —Г–Ї–ї–∞–і–Ї–Є –њ—А–Њ—Ж–µ—Б—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞. –Т—Л—П–≤–ї–µ–љ–љ—Л–є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ–њ–Њ–ї–љ—Л–Љ –Є–ї–Є –∞–±–µ—А—А–∞–љ—В–љ—Л–Љ —Б–њ–ї–∞–є—Б–Є–љ–≥–Њ–Љ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –Ї–ї–∞—Б—Б–Њ–≤ –≥–µ–љ–Њ–≤, –Ї–∞–Ї –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М —Г—З–Є—В—Л–≤–∞—П –љ–µ–є—В—А–Њ–њ–µ–љ–Є—О. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –і–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –і–∞–љ–љ–Њ–є –≥–Є–њ–Њ—В–µ–Ј—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Ї–µ–ї–µ—В–љ—Л—Е –Ї–ї–µ—В–Њ–Ї.
 
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л —В–µ—А–∞–њ–Є–Є
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ —Г—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –Р–†–Ю —П–≤–ї—П–µ—В—Б—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Є—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї (–Ґ–У–°–Ъ). –Ю—Б—В–µ–Њ–Ї–ї–∞—Б—В—Л, —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є, —П–≤–ї—П—О—В—Б—П –Ї–ї–µ—В–Ї–∞–Љ–Є –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, –њ–Њ—Н—В–Њ–Љ—Г –Ґ–У–°–Ъ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї. –Ф–∞–љ–љ–∞—П —Б—В–∞—В—М—П –љ–µ –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–µ—В –њ–Њ–і—А–Њ–±–љ–Њ–≥–Њ –Њ–њ–Є—Б–∞–љ–Є—П –Љ–µ—В–Њ–і–∞ –Ґ–У–°–Ъ: —А–µ–ґ–Є–Љ–Њ–≤ –Ї–Њ–љ–і–Є—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ –У–°–Ъ, —В–Є–њ–Њ–≤ –і–Њ–љ–Њ—А—Б—В–≤–∞, –≥—А–∞—Д–Є–Ї–∞ –Є –і—А—Г–≥–Є—Е, –±–µ–Ј —Б–Њ–Љ–љ–µ–љ–Є—П –≤–∞–ґ–љ—Л—Е, –∞—Б–њ–µ–Ї—В–Њ–≤. –Я–Њ–і—А–Њ–±–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ –љ–Є—Е –Љ–Њ–ґ–љ–Њ –љ–∞–є—В–Є –≤ –љ–µ–і–∞–≤–љ–Њ –≤—Л—И–µ–і—И–Є—Е —А–∞–±–Њ—В–∞—Е –Љ–Є—А–Њ–≤—Л—Е —Н–Ї—Б–њ–µ—А—В–Њ–≤. –Ч–і–µ—Б—М –±—Г–і—Г—В –ї–Є—И—М –≤–Ї—А–∞—В—Ж–µ –њ—А–Є–≤–µ–і–µ–љ—Л –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є.
–Т–Њ-–њ–µ—А–≤—Л—Е, –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–љ–Њ—Б—П—В –≤–∞–ґ–љ—Л–є –≤–Ї–ї–∞–і –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —В–Њ–≥–Њ, –≤ –Ї–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е —Б–ї–µ–і—Г–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –Ґ–У–°–Ъ. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, –њ–∞—Ж–Є–µ–љ—В—Л —Б –Љ—Г—В–∞—Ж–Є—П–Љ–Є RANKL –Є–ї–Є OSTM1 –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Ї–∞–љ–і–Є–і–∞—В–∞–Љ–Є –љ–∞ –і–∞–љ–љ—Г—О –њ—А–Њ—Ж–µ–і—Г—А—Г: –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –і–µ—Д–µ–Ї—В—Л –љ–µ —П–≤–ї—П—О—В—Б—П –Ї–ї–µ—В–Њ—З–љ–Њ-–∞–≤—В–Њ–љ–Њ–Љ–љ—Л–Љ–Є –Є –њ–Њ—Н—В–Њ–Љ—Г –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М —Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ—Л —Б –њ–Њ–Љ–Њ—Й—М—О –Ґ–У–°–Ъ, –∞ –≤–Њ –≤—В–Њ—А–Њ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є —Б–µ—А—М–µ–Ј–љ—Л–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л–µ —Б –ґ–Є–Ј–љ—М—О. –Ф–ї—П –њ–Њ–і–Њ–±–љ—Л—Е —Б–ї—Г—З–∞–µ–≤ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —В–µ—А–∞–њ–Є–Є, –Ї —Б–Њ–ґ–∞–ї–ї–µ–љ–Є—О, –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —В—П–ґ–µ—Б—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –і–Є–Ї—В—Г–µ—В –Љ–µ—В–Њ–і –ї–µ—З–µ–љ–Є—П: –ї–µ–≥–Ї–Є–µ —Д–Њ—А–Љ—Л, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б¬† PLEKHM1, SLC29A3 –Є–ї–Є CTSK –Є–ї–Є –і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–Љ–Є –Љ—Г—В–∞—Ж–Є—П–Љ–Є CLCN7 –љ–µ —П–≤–ї—П—О—В—Б—П –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П —А–Є—Б–Ї–Њ–≤–∞–љ–љ—Л—Е –Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ–і—Г—А, –њ—А–Њ–≤–Њ–і–Є–Љ—Л—Е –њ—А–Є –Ґ–У–°–Ъ. –Т —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П —В–Њ–ї—М–Ї–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤ —Б–ї—Г—З–∞–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –і–µ—Д–µ–Ї—В–Њ–≤ –Ј—Г–±–Њ–≤, –Њ—В–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ–±–ї–µ–Љ). –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Є –Р–†–Ю —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ CLCN7 —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ —В—Й–∞—В–µ–ї—М–љ–∞—П –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Њ—Ж–µ–љ–Ї–∞ —Б —Ж–µ–ї—М—О –њ—А–Є–љ—П—В–Є—П —А–µ—И–µ–љ–Є—П –Њ —А–µ–ї–µ–≤–∞–љ—В–љ–Њ—Б—В–Є –Ґ–У–°–Ъ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–∞—П –њ—А–Њ–≥—А–µ—Б—Б–Є–≤–љ–∞—П –і–µ–≥–µ–љ–µ—А–∞—Ж–Є—П –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—О —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В, –≤ –і–∞–љ–љ–Њ–є —Б—Г–±–≥—А—Г–њ–њ–µ –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–∞—П –Ї–Њ—А–µ–ї–ї—П—Ж–Є—П –≥–µ–љ–Њ—В–Є–њ-—Д–µ–љ–Њ—В–Є–њ, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–∞—П –≤—Л—П–≤–Є—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–і—Е–Њ–і—П—Й–Є—Е –і–ї—П –Ґ–У–°–Ъ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –ї–Є—И—М –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –і–∞–љ–љ—Л—Е.
–Э–∞–Ї–Њ–љ–µ—Ж, —З—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –љ–µ–і–∞–≤–љ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–Њ–Ї–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–∞–љ–љ—Л—Е –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є –ї–µ—З–µ–љ–Є—П –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –Њ—Б–љ–Њ–≤–љ–Њ–є.
–Т—Л–≤–Њ–і—Л
–Я–Њ—Б–ї–µ–і–љ–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї—Г—О –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В—М –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞, –Њ—Б–ї–Њ–ґ–љ—П—О—Й—Г—О –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞ –≤–Ї–ї—О—З–µ–љ—Л –±–Њ–ї–µ–µ 10 –≥–µ–љ–Њ–≤, –≤–Ї–ї—О—З–∞—П —Б–∞–Љ—Л–µ –Ї—А—Г–њ–љ—Л–µ. –°—А–µ–і–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ–Њ—А–∞–ґ–∞–µ–Љ—Л—Е –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є: –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–Є—Е –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В —Г –Љ–љ–Њ–≥–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, –і—А—Г–≥–Є–µ - –≤ –µ–і–Є–љ–Є—З–љ—Л—Е —Б–ї—Г—З–∞—П—Е, —В–∞–Ї–ґ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –љ–Њ–≤—Л–µ –Љ—Г—В–∞—Ж–Є–Є. –Я–Њ —Н—В–Є–Љ –њ—А–Є—З–Є–љ–∞–Љ, —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П (NGS), –≤–Ї–ї—О—З–∞—П –њ–Њ–ї–љ–Њ–µ —Н–Ї–Ј–Њ–Љ–љ–Њ–µ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ (WES) –Є —В–∞—А–≥–µ—В–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ–∞–ї–Є—В–Є—З–µ—Б–Ї–Є—Е –њ–∞–љ–µ–ї–µ–є, –њ—А–Њ—З–љ–Њ –≤–Њ—И–ї–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –њ—А–Њ—Ж–µ–і—Г—А—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є –Љ–µ—В–Њ–і –Є–Љ–µ–µ—В —П–≤–љ—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –≤ —Б–Ї–Њ—А–Њ—Б—В–Є –Є –±–Њ–ї–µ–µ –њ—А–Є–±–ї–Є–ґ–µ–љ –Ї —В–Њ—З–љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–є –і–ї—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Є –ї–µ—З–µ–љ–Є—П, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–Љ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ –°–µ–љ–≥–µ—А—Г –≥–µ–љ–Њ–≤-¬Ђ–Ї–∞–љ–і–Є–і–∞—В–Њ–≤¬ї.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б –њ–Њ–Љ–Њ—Й—М—О WES –≤ –µ–і–Є–љ–Є—З–љ—Л—Е —Б–ї—Г—З–∞—П—Е —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ—В–Є–њ–Є—З–љ—Л–Љ–Є —Д–µ–љ–Њ—В–Є–њ–∞–Љ–Є —Г–і–∞–ї–Њ—Б—М –Њ–њ—А–µ–і–µ–ї–Є—В—М –Љ—Г—В–∞—Ж–Є–Є –≤ –љ–Њ–≤—Л—Е –≥–µ–љ–∞—Е, –Ї–Њ—В–Њ—А—Л–µ, –Ї–∞–Ї —Г–ґ–µ –Є–Ј–≤–µ—Б—В–љ–Њ –Є–≥—А–∞—О—В —А–Њ–ї—М –≤ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є: TRAF6, LRRK1, MITF, CSF1R –Є RELA. –У–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ—А–Є —Н—В–Њ–Љ —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ—Г—О, –љ–Њ –µ—Й–µ –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —А–Њ–ї—М C16orf57 –≤ –Ї–Њ—Б—В—П—Е. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е, –±–∞–Ј–Є—Б–љ—Л–є –њ–∞—В–Њ–≥–µ–љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –≤—Б–µ –µ—Й–µ –љ—Г–ґ–і–∞–µ—В—Б—П –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Є–Ј—Г—З–µ–љ–Є–Є, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –њ–Њ –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ –Љ–Њ–ґ–љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ —Б—Г–і–Є—В—М –Њ–± –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –≤—Л—П–≤–ї–µ–љ–љ–Њ–є –Љ—Г—В–∞—Ж–Є–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, 2 –Ї–ї–∞—Б—Б–∞ –Љ—Г—В–∞—Ж–Є–є, –∞ –Є–Љ–µ–љ–љ–Њ –≥–ї—Г–±–Њ–Ї–Є–µ –Є–љ—В—А–Њ–љ–љ—Л–µ –Є–ї–Є —Б–Є–љ–Њ–љ–Є–Љ–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П WES. –Э–∞ —Б–∞–Љ–Њ–Љ –і–µ–ї–µ, –і–∞–ґ–µ –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –Љ–љ–Њ–≥–Є–µ –љ–µ–Ї–Њ–і–Є—А—Г—О—Й–Є–µ —Г—З–∞—Б—В–Ї–Є —П–≤–ї—П—О—В—Б—П —Ж–µ–ї—М—О WES, —Б—В–∞–љ–і–∞—А—В–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –њ–Њ –Њ—В–±–Њ—А—Г –≤–∞—А–Є–∞–љ—В–Њ–≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В —В–Њ–ї—М–Ї–Њ –Є–љ—В—А–Њ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –±–ї–Є–Ј–Ї–Є–µ –Ї –Ї–∞–љ–Њ–љ–Є—З–љ—Л–Љ —Б–∞–є—В–∞–Љ —Б–њ–ї–∞–є—Б–Є–љ–≥–∞; –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, —В–µ–љ–і–µ–љ—Ж–Є—О –Њ—Б—В–∞–≤–∞—В—М—Б—П –љ–µ–Ј–∞–Љ–µ—З–µ–љ–љ—Л–Љ–Є –Є–Љ–µ—О—В –≤–∞—А–Є–∞–љ—В—Л –≤ –Ї–Њ–љ—Ж–µ –њ—А–Њ—З—В–µ–љ–Є—П.
–Я–Њ—Н—В–Њ–Љ—Г, –µ—Б–ї–Є –Љ—Г—В–∞—Ж–Є—П –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–∞ –≤ –і–∞–љ–љ—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е, –Њ–љ–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–њ—Г—Й–µ–љ–∞. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є, –і–∞–љ–љ–∞—П —А–∞–±–Њ—В–∞ —П—Б–љ–Њ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В —Г 2 –љ–µ—А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е —Б–µ–Љ–µ–є –њ–∞—В–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –≥–ї—Г–±–Њ–Ї–Є—Е –Є–љ—В—А–Њ–љ–љ—Л—Е –Њ–і–љ–Њ–љ—Г–Ї–ї–µ–Њ—В–Є–і–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л—Е –≤ –≥–µ–љ–µ TCIRG1, –Ї–Њ—В–Њ—А—Л–є —Б–љ–∞—З–∞–ї–∞ –±—Л–ї –њ—А–Њ–њ—Г—Й–µ–љ WES. –°—Е–Њ–ґ–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–Є–љ–Њ–љ–Є–Љ–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —З–∞—Б—В–Њ –Њ—В—Д–Є–ї—М—В—А–Њ–≤—Л–≤–∞—О—В—Б—П –≤ —Е–Њ–і–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ—А–Є WES. –Э–∞ —Б–∞–Љ–Њ–Љ –і–µ–ї–µ, –Њ–љ–Є —З–∞—Б—В–Њ –Є–≥–љ–Њ—А–Є—А—Г—О—В—Б—П —В–∞–Ї–ґ–µ –њ—А–Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–Є –њ–Њ –°–µ–љ–≥–µ—А—Г, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ —П–≤–ї—П—О—В—Б—П ¬Ђ—В–Є—Е–Є–Љ–Є¬ї. –Ш—Б–њ—Л—В—Г–µ–Љ–∞—П –≥—А—Г–њ–њ–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ ( –Є —Н—В–Њ —Б–Њ–≤–њ–∞–і–∞–µ—В —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є), —З—В–Њ –і–∞–љ–љ–Њ–µ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –Љ–Њ–ґ–µ—В –±—Л—В—М –≤ –Ї–Њ—А–љ–µ –љ–µ–≤–µ—А–љ—Л–Љ.
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–Є –Љ–Њ–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Б–Њ–≤–µ—А—И–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –≤ –Є–Ј—Г—З–µ–љ–Є–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –±–∞–Ј—Л –Њ—Б—В–µ–Њ–њ–µ—В—А–Њ–Ј–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –Њ–Ї–Њ–ї–Њ 10 % —Б–ї—Г—З–∞–µ–≤ –≤—Б–µ –µ—Й–µ –љ—Г–ґ–і–∞—О—В—Б—П –≤ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є¬† –Є —Г –і–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±–љ–∞—А—Г–ґ–µ–љ –Љ—Г—В–∞—Ж–Є–Є –љ–Њ–≤—Л—Е, —А–∞–љ–µ–µ –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л—Е –≥–µ–љ–Њ–≤ –ї–Є–±–Њ –љ–µ—П–≤–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –Є–Ј–≤–µ—Б—В–љ—Л—Е. ¬†–Ф–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л –≤–Њ—Б–њ–Њ–ї–љ–Є—В—М –њ—А–Њ–±–µ–ї—Л, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –љ–∞–є—В–Є —Б—В—А–∞—В–µ–≥–Є—О –њ–Њ –Є–љ—В–µ–≥—А–∞—Ж–Є–Є NGS-—В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –Є —Г–ї—Г—З—И–µ–љ–Є—О —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Є–љ—В–µ—А–њ—А–µ—В–Є—А–Њ–≤–∞—В—М –≥–µ–љ–Њ–Љ–љ—Л–µ –і–∞–љ–љ—Л–µ. –Т –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Н—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є—В –Њ–њ—А–µ–і–µ–ї–Є—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —А–µ–ї–µ–≤–∞–љ—В–љ—Л–µ –≤–∞—А–Є–∞–љ—В—Л —Б—А–µ–і–Є –і–µ—Б—П—В–Ї–Њ–≤ —В—Л—Б—П—З –≤ –Ї–∞–ґ–і–Њ–Љ –Њ—В–і–µ–ї—М–љ–Њ–Љ —Н–Ї–Ј–Њ–љ–µ.
